第95页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
7. 某纯净物常用作燃料,23 g 该物质充分燃烧后只收集到$27g{H_{2}O}$和$44g{CO_{2}}$。下列关于该物质的说法正确的是 (
A.只含有碳、氢两种元素
B.碳、氢两种元素的质量比为$20:3$
C.碳、氢、氧的原子个数比为$2:6:1$
D.燃烧消耗${O_{2}}$的质量为 56 g
C
)A.只含有碳、氢两种元素
B.碳、氢两种元素的质量比为$20:3$
C.碳、氢、氧的原子个数比为$2:6:1$
D.燃烧消耗${O_{2}}$的质量为 56 g
答案:
7. C 解析:27g水中氢元素的质量为$27g×(\frac{1×2}{1×2 + 16}×100\%)=3g$,44g二氧化碳中碳元素的质量为$44g×(\frac{12}{12 + 16×2}×100\%)=12g$,根据反应前后元素的种类和质量不变,该纯净物中含有3g氢元素和12g碳元素,则该纯净物中还含有23g - 3g - 12g = 8g氧元素,A错误;结合前面分析可知,碳、氢两种元素的质量比为12g:3g = 4:1,B错误;由元素的质量比=元素的相对原子质量与原子个数的乘积之比可知,碳、氢、氧的原子个数比为$\frac{12g}{12}:\frac{3g}{1}:\frac{8g}{16}=2:6:1$,C正确;根据反应前后物质的总质量不变,燃烧消耗的氧气的质量为27g + 44g - 23g = 48g,D错误。
8. 在反应${A + 5B\xlongequal{}3C + 4D}$中,已知 2.2 g A 与 8.0 g B 恰好完全反应生成 6.6 g C。又已知 A 的相对分子质量为 44,则 D 的相对分子质量为 (
A.18
B.36
C.54
D.72
A
)A.18
B.36
C.54
D.72
答案:
8. A 解析:根据质量守恒定律可知,生成D的质量为2.2g + 8.0g - 6.6g = 3.6g;设D的相对分子质量为x。
A + 5B = 3C + 4D
44 4x
2.2g 3.6g
$\frac{4x}{44}=\frac{3.6g}{2.2g}$ x = 18
A + 5B = 3C + 4D
44 4x
2.2g 3.6g
$\frac{4x}{44}=\frac{3.6g}{2.2g}$ x = 18
9. 用${CO_{2}}$和${NH_{3}}$合成尿素[${CO(NH_{2})_{2}}$]是固定和利用${CO_{2}}$的成功范例,其反应的化学方程式为${CO_{2} + 2NH_{3}\xlongequal{一定条件}CO(NH_{2})_{2} + H_{2}O}$。下列说法正确的是 (
A.尿素中有 2 个氮原子
B.44 kg ${CO_{2}}$通过上述反应最多可以得到 60 kg 尿素
C.参加反应的${CO_{2}}$与${NH_{3}}$的质量比是$44:31$
D.尿素的相对分子质量是 60 g
B
)A.尿素中有 2 个氮原子
B.44 kg ${CO_{2}}$通过上述反应最多可以得到 60 kg 尿素
C.参加反应的${CO_{2}}$与${NH_{3}}$的质量比是$44:31$
D.尿素的相对分子质量是 60 g
答案:
9. B 解析:尿素是指宏观意义上的一种物质,氮原子是微观意义上的一种粒子,1个尿素分子中含有2个氮原子,不能说尿素中有2个氮原子,A错误;设44kgCO₂通过题述反应最多可以得到尿素的质量为x。
CO₂ + 2NH₃$\stackrel{一定条件}{=\!=\!=}$CO(NH₂)₂ + H₂O
44 60
44kg x
$\frac{44}{60}=\frac{44kg}{x}$ x = 60kg
B正确;由反应的化学方程式可知,参加反应的CO₂与NH₃的质量比是44:(2×17)=44:34,C错误;相对分子质量的单位是“1”,通常省略不写,故尿素的相对分子质量是60,D错误。
CO₂ + 2NH₃$\stackrel{一定条件}{=\!=\!=}$CO(NH₂)₂ + H₂O
44 60
44kg x
$\frac{44}{60}=\frac{44kg}{x}$ x = 60kg
B正确;由反应的化学方程式可知,参加反应的CO₂与NH₃的质量比是44:(2×17)=44:34,C错误;相对分子质量的单位是“1”,通常省略不写,故尿素的相对分子质量是60,D错误。
10. (科技民生)芯片被称为“现代工业的粮食”,高纯硅可用于制造计算机芯片。工业上常用焦炭在高温下和二氧化硅反应制取硅,主要反应为${SiO_{2} + 2C\xlongequal{高温}Si + 2CO\uparrow }$。
(1) 硅在地壳中的含量居第
(2) ${SiO_{2}}$中硅元素与氧元素的质量比为
(3) 求若要制取 5.6 kg 的硅,至少需要焦炭的质量。(写出计算过程)
(1) 硅在地壳中的含量居第
二
位。(2) ${SiO_{2}}$中硅元素与氧元素的质量比为
7:8
(填最简整数比)。(3) 求若要制取 5.6 kg 的硅,至少需要焦炭的质量。(写出计算过程)
答案:
10.
(1)二
(2)7:8
(3)解:设至少需要焦炭的质量为x。
SiO₂ + 2C$\stackrel{高温}{=\!=\!=}$Si + 2CO↑
24 28
x 5.6kg
$\frac{24}{28}=\frac{x}{5.6kg}$ x = 4.8kg
答:若要制取5.6kg的硅,至少需要焦炭的质量是4.8kg。
(1)二
(2)7:8
(3)解:设至少需要焦炭的质量为x。
SiO₂ + 2C$\stackrel{高温}{=\!=\!=}$Si + 2CO↑
24 28
x 5.6kg
$\frac{24}{28}=\frac{x}{5.6kg}$ x = 4.8kg
答:若要制取5.6kg的硅,至少需要焦炭的质量是4.8kg。
11. 某同学对一道计算题的解题过程如图。
题目:实验室用 24.5 g 含 30%二氧化锰的氯酸钾混合物制取氧气,完全反应后,可制得多少克的氧气?

(1) 框内的解题过程中,错误的步骤有
(2) 请你写出该题的正确解题过程。
题目:实验室用 24.5 g 含 30%二氧化锰的氯酸钾混合物制取氧气,完全反应后,可制得多少克的氧气?

(1) 框内的解题过程中,错误的步骤有
①②④⑤⑥
(填序号)。(2) 请你写出该题的正确解题过程。
答案:
11.
(1)①②④⑤⑥
(2)解:设可制得氧气的质量为x。
2KClO₃$\stackrel{MnO_2}{\underset{\triangle}{=\!=\!=}}$2KCl + 3O₂↑
245 96
24.5g×(1 - 30%) x
$\frac{245}{96}=\frac{24.5g×(1 - 30\%)}{x}$ x = 6.72g
答:可制得6.72g的氧气。
(1)①②④⑤⑥
(2)解:设可制得氧气的质量为x。
2KClO₃$\stackrel{MnO_2}{\underset{\triangle}{=\!=\!=}}$2KCl + 3O₂↑
245 96
24.5g×(1 - 30%) x
$\frac{245}{96}=\frac{24.5g×(1 - 30\%)}{x}$ x = 6.72g
答:可制得6.72g的氧气。
12. 为测定某种贝壳中主要成分碳酸钙的含量,小华将 10 g 贝壳样品煅烧,实验数据记录如下表。(杂质不参与反应,反应的化学方程式是${CaCO_{3}\xlongequal{高温}CaO + CO_{2}\uparrow }$)
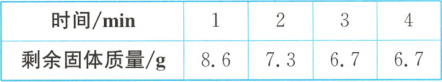
(1)
(2) 计算该贝壳样品中碳酸钙的质量。
(3) 该贝壳样品中碳酸钙的质量分数为

(1)
3
min 时,碳酸钙已完全分解,生成二氧化碳的质量为3.3
g。(2) 计算该贝壳样品中碳酸钙的质量。
(3) 该贝壳样品中碳酸钙的质量分数为
75%
。
答案:
12.
(1)3 3.3
(2)解:设该贝壳样品中碳酸钙的质量为x。
CaCO₃$\stackrel{高温}{=\!=\!=}$CaO + CO₂↑
100 44
x 3.3g
$\frac{100}{44}=\frac{x}{3.3g}$ x = 7.5g
答:该贝壳样品中碳酸钙的质量为7.5g。
(3)75%
(1)3 3.3
(2)解:设该贝壳样品中碳酸钙的质量为x。
CaCO₃$\stackrel{高温}{=\!=\!=}$CaO + CO₂↑
100 44
x 3.3g
$\frac{100}{44}=\frac{x}{3.3g}$ x = 7.5g
答:该贝壳样品中碳酸钙的质量为7.5g。
(3)75%
查看更多完整答案,请扫码查看


