第71页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
1. 下列有关生活中金属的知识错误的是(
A.优质水龙头的内芯都使用了铜,利用了铜合金的硬度大、机械加工性能好及抗腐蚀性能强的优点
B.不锈钢材料是在一般的钢材中加入适量的钨、锰等金属,所以抗锈蚀能力强
C.生铁、钢、纯铁比较,生铁的熔点最低,纯铁的硬度最低
D.某同学的铜制眼镜框表面出现了绿色物质(主要成分是碱式碳酸铜),可用稀盐酸除去
B
)A.优质水龙头的内芯都使用了铜,利用了铜合金的硬度大、机械加工性能好及抗腐蚀性能强的优点
B.不锈钢材料是在一般的钢材中加入适量的钨、锰等金属,所以抗锈蚀能力强
C.生铁、钢、纯铁比较,生铁的熔点最低,纯铁的硬度最低
D.某同学的铜制眼镜框表面出现了绿色物质(主要成分是碱式碳酸铜),可用稀盐酸除去
答案:
B
2. (2024·徐州云龙月考)一定量的铁和硫酸铜溶液充分反应后,过滤,分别得到滤液和滤渣,下列说法不正确的是(
A.若滤液为浅绿色,滤渣中可能含有铁
B.滤渣中一定含有铜
C.滤液中可能含有硫酸亚铁
D.反应后滤渣质量大于铁的质量
C
)A.若滤液为浅绿色,滤渣中可能含有铁
B.滤渣中一定含有铜
C.滤液中可能含有硫酸亚铁
D.反应后滤渣质量大于铁的质量
答案:
C 提示:铁和硫酸铜反应生成硫酸亚铁和铜,若滤液为浅绿色,可能是铁和硫酸铜恰好完全反应,也可能是铁有剩余,则滤渣中可能含有铁,一定含有铜,滤液中一定含有硫酸亚铁;反应的化学方程式为Fe+CuSO₄=FeSO₄+Cu,每56份质量的铁可置换出64份质量的铜,反应后滤渣质量大于铁的质量。
3. (2024·盐城亭湖模拟)用等质量、相同表面积的镁条,等体积、不同浓度的盐酸在一定条件下反应,实验结果如图所示。下列结论正确的是(
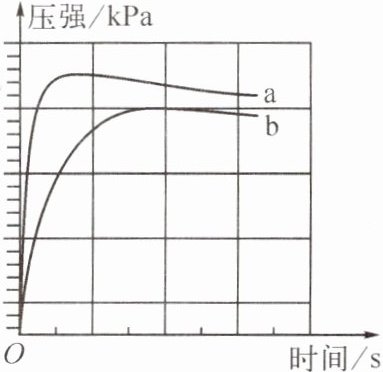
A.镁与盐酸的反应是放热反应,且单位时间内放出热量越多,反应速率越快
B.b 曲线对应的盐酸浓度较大,盐酸浓度越大,反应速率越快
C.装置内氢气的质量先增大,后减小
D.两种情况最终产生氢气的质量一定不相同
A
)
A.镁与盐酸的反应是放热反应,且单位时间内放出热量越多,反应速率越快
B.b 曲线对应的盐酸浓度较大,盐酸浓度越大,反应速率越快
C.装置内氢气的质量先增大,后减小
D.两种情况最终产生氢气的质量一定不相同
答案:
A 提示:压强达到最大后略有减小,是因为温度降低,说明反应放热。无论什么时刻,a曲线的压强均比b曲线的大,说明a曲线对应的盐酸浓度较大。装置内氢气的质量先增大,后不变。若镁过量,则等体积的不同浓度的盐酸完全反应,根据氯元素守恒,由于参加反应的氯化氢的质量不等,则生成的氢气质量不同;若镁不足时,生成的氢气由镁决定,镁的质量相等,则生成氢气的质量相等。
4. 一定质量含杂质的铁(杂质不溶于水,也不参与反应)与$ 16gCuSO_4 $形成的溶液恰好完全反应,过滤得到干燥的固体 6.8g,则含杂质的铁的质量是(
A.6.0g
B.5.6g
C.16g
D.6.4g
A
)A.6.0g
B.5.6g
C.16g
D.6.4g
答案:
A 提示:设样品中铁的质量为x,生成铜的质量为y。
Fe+CuSO₄=FeSO₄+Cu
56 160 64
x 16g y
56/160=x/16g,64/160=y/16g
解得:x=5.6g,y=6.4g。
含杂质的铁的质量为5.6g+(6.8g-6.4g)=6.0g。
Fe+CuSO₄=FeSO₄+Cu
56 160 64
x 16g y
56/160=x/16g,64/160=y/16g
解得:x=5.6g,y=6.4g。
含杂质的铁的质量为5.6g+(6.8g-6.4g)=6.0g。
(1)铅锡合金中某种金属的质量分数与合金的熔点有如图所示的关系,其中横坐标表示的是
(2)保险丝由铋、铅、锡、镉组成,其熔点约为
锡
的质量分数;当合金熔点最低时,合金中铅与锡的质量比为2:3
。(2)保险丝由铋、铅、锡、镉组成,其熔点约为
B
。
答案:
(1)锡 2:3 (2)B 提示:(1)横坐标质量分数为0时熔点要比质量分数为100%时熔点高,因为铅的熔点比锡的熔点高,所以横坐标表示锡的质量分数;合金熔点最低时锡占60%,所以铅占40%,则合金中铅与锡的质量比为40%:60%=2:3。(2)合金的熔点比它的组成成分熔点低,铋、铅、锡、镉这四种物质的最低熔点是231.9℃,所以合金熔点比231.9℃低,但不能很低,必须要高于室温。
6. (武汉武昌模拟)某课外活动小组的同学用铁粉和铜粉的混合物按下图流程进行实验,回答相关问题。
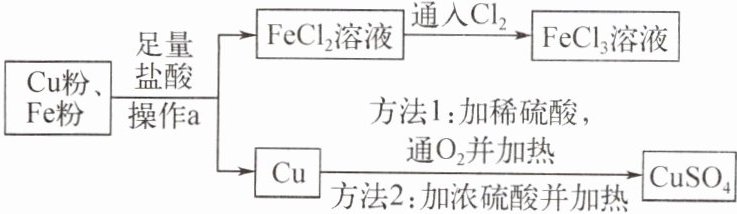
已知:Cu + 2H₂SO₄(浓) $\xlongequal{\triangle}$ CuSO₄ + SO₂↑ + 2H₂O。
(1)操作 a 的名称是
(2)写出 FeCl₂ 溶液通入 Cl₂ 时发生反应的化学方程式:
(3)方法 1 若不通入 O₂,反应将不会发生,原因是
(4)通常选方法 1 而不选方法 2 的理由是

已知:Cu + 2H₂SO₄(浓) $\xlongequal{\triangle}$ CuSO₄ + SO₂↑ + 2H₂O。
(1)操作 a 的名称是
过滤
。(2)写出 FeCl₂ 溶液通入 Cl₂ 时发生反应的化学方程式:
2FeCl₂+Cl₂=2FeCl₃
。(3)方法 1 若不通入 O₂,反应将不会发生,原因是
在金属活动性顺序中,铜位于氢之后,与稀硫酸不反应
。(4)通常选方法 1 而不选方法 2 的理由是
方法1不会产生污染空气的二氧化硫气体,方法2会产生有毒的二氧化硫气体,污染空气
。
答案:
(1)过滤 (2)2FeCl₂+Cl₂=2FeCl₃ (3)在金属活动性顺序中,铜位于氢之后,与稀硫酸不反应 (4)方法1不会产生污染空气的二氧化硫气体,方法2会产生有毒的二氧化硫气体,污染空气
查看更多完整答案,请扫码查看


