第70页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
5. (南京鼓楼模拟)铁矿石炼铁的原理:在高温下,利用炉内反应生成的一氧化碳把铁从铁矿石中还原出来。冶炼 2 000 t 含杂质 3%的生铁,需要含$ Fe_3O_4 90%$的磁铁矿石的质量是多少? (请利用化学方程式进行计算,写出完整计算过程,计算结果保留整数)
答案:
纯铁的质量为2000 t×(1-3%)=1940 t。解:设需要含Fe₃O₄ 90% 的磁铁矿石的质量为x。Fe₃O₄+4CO$\frac{\underline{\;高温\;}}{}$3Fe+4CO₂232 16890%×x 1940 t$\frac{232}{168}$=$\frac{90\%× x}{1940\ \text{t}}$解得:x≈2977 t答:需要含Fe₃O₄ 90% 的磁铁矿石的质量为2977 t。
6. 某化学兴趣小组对一包干燥的红色粉末组成进行探究。请你参与并回答有关问题。
【教师提醒】它由 Cu、$Fe_2O_3$两种固体中的一种或两种组成。
【提出猜想】红色粉末可能的组成:
①只有 Cu;
②只有
③是 Cu、$Fe_2O_3$的混合物。
【资料获悉】
$①Fe_2O_3 + 6HCl = 2FeCl_3 + 3H_2O;$
②Cu 在$ FeCl_3$溶液中发生反应$: 2FeCl_3 + Cu = 2FeCl_2 + CuCl_2。$
【实验探究】
(1) 甲同学取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解。甲同学认为可以排除猜想中的①和③,而乙同学认为只能排除猜想①,你认为
(2) 丙同学为进一步确定红色粉末的组成,称取该粉末 5.0 g 装入硬质玻璃管中,按下图在通风橱中进行实验。开始时缓缓通入 CO 气体,过一段时间后再加热使其充分反应,待反应完全后,停止加热,仍继续通入 CO 气体直至玻璃管冷却,反应前后称量相关装置和物质的总质量如下表所示。
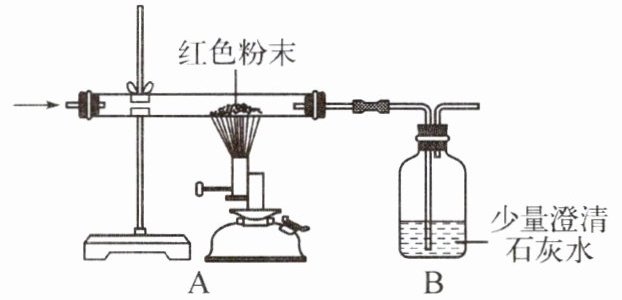
|组别|反应前|反应后|
|Ⅰ组|玻璃管和红色粉末的总质量为 37.3 g|玻璃管和固体物质的总质量为 36.1 g|
|Ⅱ组|洗气瓶和所盛溶液的总质量为 180.0 g|洗气瓶和瓶中物质的总质量为 183.1 g|
【交流讨论】
(1) 在装置 A 中先通 CO 气体的作用是
(2) 应该选择
(3) 为了防止溶液倒吸,本实验停止加热前是否需要先断开 A 和 B 的连接处?
【反思评价】丁同学指出:从环保角度,上图装置有严重不足之处。你认为应该如何改进?
【教师提醒】它由 Cu、$Fe_2O_3$两种固体中的一种或两种组成。
【提出猜想】红色粉末可能的组成:
①只有 Cu;
②只有
$Fe_2O_3$
;③是 Cu、$Fe_2O_3$的混合物。
【资料获悉】
$①Fe_2O_3 + 6HCl = 2FeCl_3 + 3H_2O;$
②Cu 在$ FeCl_3$溶液中发生反应$: 2FeCl_3 + Cu = 2FeCl_2 + CuCl_2。$
【实验探究】
(1) 甲同学取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解。甲同学认为可以排除猜想中的①和③,而乙同学认为只能排除猜想①,你认为
乙
(填“甲”或“乙”)的观点正确。(2) 丙同学为进一步确定红色粉末的组成,称取该粉末 5.0 g 装入硬质玻璃管中,按下图在通风橱中进行实验。开始时缓缓通入 CO 气体,过一段时间后再加热使其充分反应,待反应完全后,停止加热,仍继续通入 CO 气体直至玻璃管冷却,反应前后称量相关装置和物质的总质量如下表所示。

|组别|反应前|反应后|
|Ⅰ组|玻璃管和红色粉末的总质量为 37.3 g|玻璃管和固体物质的总质量为 36.1 g|
|Ⅱ组|洗气瓶和所盛溶液的总质量为 180.0 g|洗气瓶和瓶中物质的总质量为 183.1 g|
【交流讨论】
(1) 在装置 A 中先通 CO 气体的作用是
排尽装置中的空气(或防止CO 和装置中的空气混合受热发生爆炸)
。(2) 应该选择
Ⅰ
(填编号)组的实验数据计算来确定红色粉末的组成。最终计算结果表明:该红色粉末的组成是猜想中的第③
(填序号)组。(3) 为了防止溶液倒吸,本实验停止加热前是否需要先断开 A 和 B 的连接处?
不需要
(填“需要”或“不需要”),理由是因为一直通入CO气体,B中溶液不会倒吸到A装置中
。【反思评价】丁同学指出:从环保角度,上图装置有严重不足之处。你认为应该如何改进?
在B装置后放一盏燃着的酒精灯将剩余气体点燃(或用气球收集等)
。
答案:
【提出猜想】Fe₂O₃【实验探究】
(1)乙【交流讨论】
(1)排尽装置中的空气(或防止CO 和装置中的空气混合受热发生爆炸)(2)Ⅰ③(3)不需要因为一直通入CO气体,B中溶液不会倒吸到A装置中【反思评价】在B装置后放一盏燃着的酒精灯将剩余气体点燃(或用气球收集等)提示:【交流讨论】
(2)第Ⅱ组数据不能证明二氧化碳完全反应,因为少量石灰水不一定能完全吸收,且与空气相通,会受到空气中二氧化碳的干扰;应该选择Ⅰ组的实验数据计算来确定红色粉末的组成。玻璃管中固体减少的质量昰氧化铁中氧元素的质量,为37.3 g-36.1 g=1.2 g,可求得氧化铁的质量为$\frac{1.2\ \text{g}}{\frac{48}{160}×100\%}$=4 g<5 g ,所以红色粉末中含有铜粉。【反思评价】此反应应考虑到CO有毒,排放到空气中会污染环境,显然该装置没有对尾气进行处理
(1)乙【交流讨论】
(1)排尽装置中的空气(或防止CO 和装置中的空气混合受热发生爆炸)(2)Ⅰ③(3)不需要因为一直通入CO气体,B中溶液不会倒吸到A装置中【反思评价】在B装置后放一盏燃着的酒精灯将剩余气体点燃(或用气球收集等)提示:【交流讨论】
(2)第Ⅱ组数据不能证明二氧化碳完全反应,因为少量石灰水不一定能完全吸收,且与空气相通,会受到空气中二氧化碳的干扰;应该选择Ⅰ组的实验数据计算来确定红色粉末的组成。玻璃管中固体减少的质量昰氧化铁中氧元素的质量,为37.3 g-36.1 g=1.2 g,可求得氧化铁的质量为$\frac{1.2\ \text{g}}{\frac{48}{160}×100\%}$=4 g<5 g ,所以红色粉末中含有铜粉。【反思评价】此反应应考虑到CO有毒,排放到空气中会污染环境,显然该装置没有对尾气进行处理
查看更多完整答案,请扫码查看


