第55页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
1. (东莞期末)下列有关燃烧和灭火的说法正确的是 (
A.电器着火时,用水浇灭
B.用水灭火是因为降低了可燃物的着火点
C.把木柴架空,有利于木柴充分燃烧
D.室内着火,马上打开所有门窗
C
)A.电器着火时,用水浇灭
B.用水灭火是因为降低了可燃物的着火点
C.把木柴架空,有利于木柴充分燃烧
D.室内着火,马上打开所有门窗
答案:
C
2. (昆明五华期末)如图所示为某化学反应的微观示意图(图中不同的球代表不同的原子),下列关于该反应叙述正确的是 (
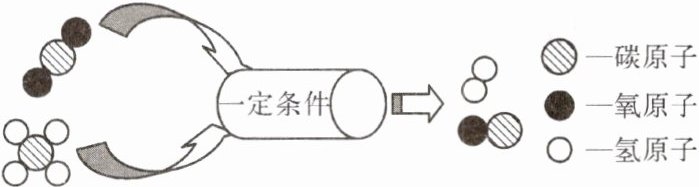
A.该反应不遵守质量守恒定律
B.该反应生成物的化学计量数之比为$1:1$
C.该反应前后分子数目没有发生改变
D.该反应属于化学基本反应类型中的化合反应
B
)
A.该反应不遵守质量守恒定律
B.该反应生成物的化学计量数之比为$1:1$
C.该反应前后分子数目没有发生改变
D.该反应属于化学基本反应类型中的化合反应
答案:
B 提示:由图可知,该反应的化学方程式是CH₄+CO₂$\frac{\underline{\;一定条件\;}}{}$2CO+2H₂。所有化学反应都遵循质量守恒定律;该反应前后分子数目发生了改变;该反应是两种物质生成两种物质,不符合“多变一”的特点,不属于化合反应。
3. (2024·南京秦淮期中)在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如下图所示。图中a、b、c、d分别表示相应物质的质量分数。下列数据正确的是 (

A.$a= 17\%$
B.$b= 8\%$
C.$c= 42\%$
D.$d= 6\%$
C
)
A.$a= 17\%$
B.$b= 8\%$
C.$c= 42\%$
D.$d= 6\%$
答案:
C 提示:由图中数据可知,反应前后丁的质量分数都是10%,则反应过程中丁的质量分数也是10%,即b=10%。反应第一阶段甲减少了70%-56%=14%,则甲是反应物;乙减少了14%-11%=3%,则乙是反应物;由于丁可能是催化剂也可能是杂质,只有丙是生成物,则丙的质量分数增加14%+3%=17%,a=6%+17%=23%。综上可知,参与反应的甲、乙、丙的质量变化比为14:3:17,而反应后丙的质量分数增加了40%-6%=34%,则甲的质量分数减少了34%×$\frac{14}{17}$=28%,乙的质量分数减少了34%-28%=6%,所以c=70%-28%=42%,d=14%-6%=8%。
4. (2024·合肥蜀山月考)密闭容器中只有甲、乙、丁三种物质,在一定条件下发生了一个化学反应,容器中丙的质量随甲、乙、丁的质量变化情况如图所示。下列说法错误的是 (
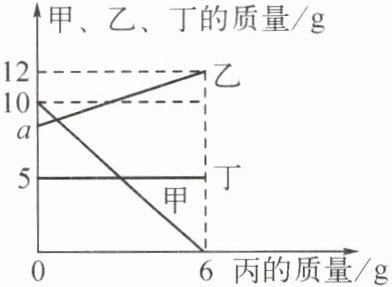
A.丁可能是该反应的催化剂
B.$a= 8$
C.乙、丙参加反应的质量之比为$2:3$
D.当甲为5g时,容器中乙和丁的质量之比为$1:2$
D
)
A.丁可能是该反应的催化剂
B.$a= 8$
C.乙、丙参加反应的质量之比为$2:3$
D.当甲为5g时,容器中乙和丁的质量之比为$1:2$
答案:
D 提示:可将图中数据转化成下表:
物质甲乙丙丁
反应前质量/g10a05
反应后质量/g01265
反应前后丁的质量不变,则丁可能是该反应的催化剂,也可能是杂质;根据质量守恒定律可知,10+a+0+5=0+12+6+5,a=8;乙、丙参加反应的质量之比为(12-8):(6-0)=2:3;该反应是甲在一定条件下反应生成乙和丙,当甲为5g时,参加反应的甲的质量为10g-5g=5g,生成乙的质量为5g×$\frac{2}{5}$=2g,容器中乙的总质量=2g+8g=10g,则乙和丁的质量之比为10g:5g=2:1。
物质甲乙丙丁
反应前质量/g10a05
反应后质量/g01265
反应前后丁的质量不变,则丁可能是该反应的催化剂,也可能是杂质;根据质量守恒定律可知,10+a+0+5=0+12+6+5,a=8;乙、丙参加反应的质量之比为(12-8):(6-0)=2:3;该反应是甲在一定条件下反应生成乙和丙,当甲为5g时,参加反应的甲的质量为10g-5g=5g,生成乙的质量为5g×$\frac{2}{5}$=2g,容器中乙的总质量=2g+8g=10g,则乙和丁的质量之比为10g:5g=2:1。
5. 称取m g $CaC_{2}O_{4}\cdot H_{2}O$(相对分子质量为146,其中氧元素的化合价为-2)置于氮气流中加热,残留固体质量随温度的变化如下图所示(图中各点对应固体均为纯净物),其中$A→B$发生反应:$CaC_{2}O_{4}\cdot H_{2}O\xlongequal {△}CaC_{2}O_{4}+H_{2}O$。下列说法正确的是 (
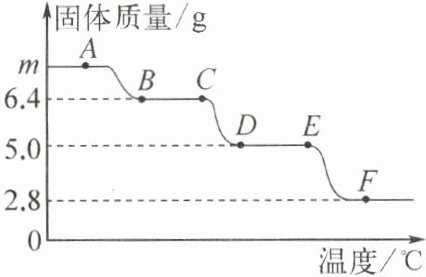
A.$CaC_{2}O_{4}$中碳元素的化合价为+2
B.$m= 8.2$
C.$C→D发生反应的化学方程式为CaC_{2}O_{4}\xlongequal {△}CaCO_{3}+CO\uparrow$
D.F点对应固体的化学式为$Ca(OH)_{2}$
C
)
A.$CaC_{2}O_{4}$中碳元素的化合价为+2
B.$m= 8.2$
C.$C→D发生反应的化学方程式为CaC_{2}O_{4}\xlongequal {△}CaCO_{3}+CO\uparrow$
D.F点对应固体的化学式为$Ca(OH)_{2}$
答案:
C 提示:CaC₂O₄中碳元素的化合价为+3;根据题中A→B反应的化学方程式,可知146份质量的CaC₂O₄·H₂O可分解产生128份质量的CaC₂O₄,故分解产生6.4g CaC₂O₄需要CaC₂O₄·H₂O的质量为7.3g,即m=7.3;根据C选项的反应及图像中的数据可知,6.4g CaC₂O₄分解恰好产生5.0g CaCO₃;根据元素守恒可知,D点对应固体中无氢元素,则F点对应固体不可能为Ca(OH)₂。
6. 技术创新可减少化石燃料使用,降低污染。
(1) 美国科学家发明了一种“发电叶子”,将这种叶子放入水中,在太阳光照射下,叶子中的催化剂会将水分解成氢气和氧气储存在氢氧燃料电池中,再转化为电能,供家庭用电需求。“发电叶子”产生氢气、氧气的化学方程式为
(2) 汽车安装催化式排气净化器可减轻尾气污染。下图列举的是几种气体在净化器中转换前后的变化。有害气体NO和CO在催化式排气净化器中发生反应的化学方程式为

(3) $NO_{2}$能与水反应形成硝酸(R)导致酸雨,其化学方程式是$3NO_{2}+H_{2}O= 2R+NO$,则R的化学式是
(1) 美国科学家发明了一种“发电叶子”,将这种叶子放入水中,在太阳光照射下,叶子中的催化剂会将水分解成氢气和氧气储存在氢氧燃料电池中,再转化为电能,供家庭用电需求。“发电叶子”产生氢气、氧气的化学方程式为
2H₂O$\frac{\underline{\;催化剂\;}}{光照}$2H₂↑+O₂↑
。(2) 汽车安装催化式排气净化器可减轻尾气污染。下图列举的是几种气体在净化器中转换前后的变化。有害气体NO和CO在催化式排气净化器中发生反应的化学方程式为
2NO + 2CO$\frac{\underline{\;催化剂\;}}{}$2CO₂ + N₂
。
(3) $NO_{2}$能与水反应形成硝酸(R)导致酸雨,其化学方程式是$3NO_{2}+H_{2}O= 2R+NO$,则R的化学式是
HNO₃
。
答案:
(1)2H₂O$\frac{\underline{\;催化剂\;}}{光照}$2H₂↑+O₂↑
(2)2NO + 2CO$\frac{\underline{\;催化剂\;}}{}$2CO₂ + N₂
(3)HNO₃
(1)2H₂O$\frac{\underline{\;催化剂\;}}{光照}$2H₂↑+O₂↑
(2)2NO + 2CO$\frac{\underline{\;催化剂\;}}{}$2CO₂ + N₂
(3)HNO₃
查看更多完整答案,请扫码查看


