第68页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
7. (苏州中考)$CO_{2}$作为一种碳资源,被广泛应用于工农业生产。
Ⅰ. 植物气肥。
(1) 在蔬菜大棚内增大$CO_{2}$浓度,有利于植物进行
Ⅱ. 生产化肥。
(2) 二氧化碳和氨气可以生产尿素$[CO(NH_{2})_{2}]$和碳酸氢铵。
①合成尿素的化学反应为$CO_{2}+2NH_{3}= CO(NH_{2})_{2}+X$,$X$的化学式是
②合成碳酸氢铵的反应为$CO_{2}+NH_{3}+H_{2}O= NH_{4}HCO_{3}$,该反应需要在较
(3) 理论上,相同质量的$NH_{3}$分别生产$CO(NH_{2})_{2}$和$NH_{4}HCO_{3}$,消耗$CO_{2}$的质量比为
Ⅲ. 催化重整。
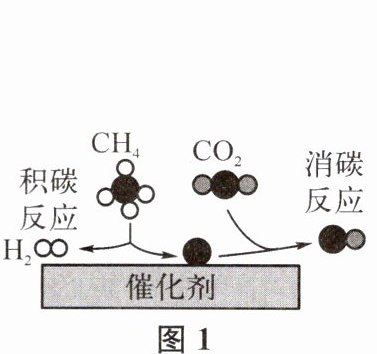
(4)$CH_{4}$与$CO_{2}$在催化剂作用下可得到合成气($CO和H_{2}$),反应过程中催化剂表面还同时存在积碳反应和消碳反应,原理如图1所示。
①消碳反应的产物“●○”是
②为减少催化剂表面的积碳,可在原料气中加入适量
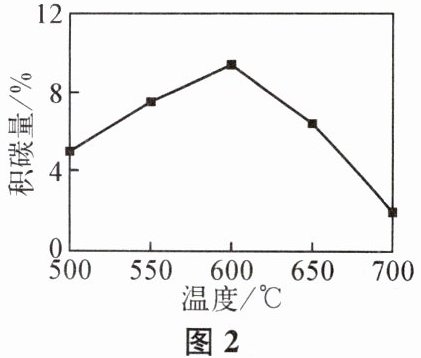
③其他条件不变,催化剂表面的积碳量随温度变化如图2所示。温度高于$600^{\circ}C$,催化剂表面积碳量减少的原因可能是
Ⅰ. 植物气肥。
(1) 在蔬菜大棚内增大$CO_{2}$浓度,有利于植物进行
光合作用
,促进生长。Ⅱ. 生产化肥。
(2) 二氧化碳和氨气可以生产尿素$[CO(NH_{2})_{2}]$和碳酸氢铵。
①合成尿素的化学反应为$CO_{2}+2NH_{3}= CO(NH_{2})_{2}+X$,$X$的化学式是
$\mathrm{H}_{2}\mathrm{O}$
。②合成碳酸氢铵的反应为$CO_{2}+NH_{3}+H_{2}O= NH_{4}HCO_{3}$,该反应需要在较
低
(填“高”或“低”)温度下进行。(3) 理论上,相同质量的$NH_{3}$分别生产$CO(NH_{2})_{2}$和$NH_{4}HCO_{3}$,消耗$CO_{2}$的质量比为
$1:2$
。Ⅲ. 催化重整。
(4)$CH_{4}$与$CO_{2}$在催化剂作用下可得到合成气($CO和H_{2}$),反应过程中催化剂表面还同时存在积碳反应和消碳反应,原理如图1所示。
①消碳反应的产物“●○”是
$\mathrm{CO}$
。②为减少催化剂表面的积碳,可在原料气中加入适量
$\mathrm{O}_{2}$(或氧气)
气体。

③其他条件不变,催化剂表面的积碳量随温度变化如图2所示。温度高于$600^{\circ}C$,催化剂表面积碳量减少的原因可能是
温度升高,消碳反应所消耗的碳的量多于积碳反应产生的碳的量
。
答案:
(1)光合作用 (2)①$\mathrm{H}_{2}\mathrm{O}$ ②低 (3)$1:2$ (4)①$\mathrm{CO}$ ②$\mathrm{O}_{2}$(或氧气) ③温度升高,消碳反应所消耗的碳的量多于积碳反应产生的碳的量 提示:
(2)②由合成碳酸氢铵的化学方程式可知,该反应需在较低温度下进行,因为高温会导致$\mathrm{NH}_{4}\mathrm{HCO}_{3}$分解。(3)理论上,相同质量的$\mathrm{NH}_{3}$分别生产$\mathrm{CO}(\mathrm{NH}_{2})_{2}$和$\mathrm{NH}_{4}\mathrm{HCO}_{3}$,消耗$\mathrm{CO}_{2}$的质量比可通过相应化学式中的碳、氮原子个数比进行确定,为$\frac{1}{2}:\frac{1}{1}=1:2$;也可以通过相应的化学方程式计算得出。(4)②为减少催化剂表面的积碳,可利用积碳的可燃性在原料气中加入适量的$\mathrm{O}_{2}$,使积碳及时转化为一氧化碳气体。
(2)②由合成碳酸氢铵的化学方程式可知,该反应需在较低温度下进行,因为高温会导致$\mathrm{NH}_{4}\mathrm{HCO}_{3}$分解。(3)理论上,相同质量的$\mathrm{NH}_{3}$分别生产$\mathrm{CO}(\mathrm{NH}_{2})_{2}$和$\mathrm{NH}_{4}\mathrm{HCO}_{3}$,消耗$\mathrm{CO}_{2}$的质量比可通过相应化学式中的碳、氮原子个数比进行确定,为$\frac{1}{2}:\frac{1}{1}=1:2$;也可以通过相应的化学方程式计算得出。(4)②为减少催化剂表面的积碳,可利用积碳的可燃性在原料气中加入适量的$\mathrm{O}_{2}$,使积碳及时转化为一氧化碳气体。
查看更多完整答案,请扫码查看


