第48页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
8. (2024·重庆九龙坡期中)地球是一个巨大的生态系统,森林对保护和改善人类的生存环境有着十分重要的作用。科学实验证明,1 公顷柳杉林每月可以吸收 $ 160 \ \text{kg} \ {SO_{2}} $;用 $ {CaO} $ 吸收二氧化硫的反应原理为 $ {2SO_{2} + O_{2} + 2CaO \xlongequal{} 2CaSO_{4}} $。某火力发电厂每月要排放出 $ 32 \ \text{t} \ {SO_{2}} $,通过计算解答问题:
(1) 若要完全吸收该厂排放出的 $ {SO_{2}} $,则至少需要栽种柳杉林
(2) 若用 $ {CaO} $ 吸收该厂排放的 $ {SO_{2}} $,则每月消耗含 $ {CaO} $ 为 $ 70\% $ 的原料质量是多少?
(3) 若硫酸钙的市场报价为 $ 500 $ 元/$\text{t}$,则每月得到的硫酸钙可获得的价值为多少元?
(1) 若要完全吸收该厂排放出的 $ {SO_{2}} $,则至少需要栽种柳杉林
200
公顷。(2) 若用 $ {CaO} $ 吸收该厂排放的 $ {SO_{2}} $,则每月消耗含 $ {CaO} $ 为 $ 70\% $ 的原料质量是多少?
解:设每月消耗CaO的质量是x,生成硫酸钙的质量为y。
2SO₂+O₂+2CaO$\xlongequal{\;\;}$2CaSO₄
128 112 272
32 t x y
$\frac{128}{112}=\frac{32\;\text{t}}{x}$,$\frac{128}{272}=\frac{32\;\text{t}}{y}$
解得:x=28 t,y=68 t。
则每月消耗含CaO为70%的原料质量为$\frac{28\;\text{t}}{70\%}$=40 t。
答:每月消耗含CaO为70%的原料质量是40 t。
2SO₂+O₂+2CaO$\xlongequal{\;\;}$2CaSO₄
128 112 272
32 t x y
$\frac{128}{112}=\frac{32\;\text{t}}{x}$,$\frac{128}{272}=\frac{32\;\text{t}}{y}$
解得:x=28 t,y=68 t。
则每月消耗含CaO为70%的原料质量为$\frac{28\;\text{t}}{70\%}$=40 t。
答:每月消耗含CaO为70%的原料质量是40 t。
(3) 若硫酸钙的市场报价为 $ 500 $ 元/$\text{t}$,则每月得到的硫酸钙可获得的价值为多少元?
每月得到的硫酸钙可获得的价值为68 t×500元/t=34000元。
答:每月得到的硫酸钙可获得的价值为34000元。
答:每月得到的硫酸钙可获得的价值为34000元。
答案:
(1)200
(2)解:设每月消耗CaO的质量是x,生成硫酸钙的质量为y。
2SO₂+O₂+2CaO$\xlongequal{\;\;}$2CaSO₄
128 112 272
32 t x y
$\frac{128}{112}=\frac{32\;\text{t}}{x}$,$\frac{128}{272}=\frac{32\;\text{t}}{y}$
解得:x=28 t,y=68 t。
则每月消耗含CaO为70%的原料质量为$\frac{28\;\text{t}}{70\%}$=40 t。
答:每月消耗含CaO为70%的原料质量是40 t。
(3)每月得到的硫酸钙可获得的价值为68 t×500元/t=34000元。
答:每月得到的硫酸钙可获得的价值为34000元。
(2)解:设每月消耗CaO的质量是x,生成硫酸钙的质量为y。
2SO₂+O₂+2CaO$\xlongequal{\;\;}$2CaSO₄
128 112 272
32 t x y
$\frac{128}{112}=\frac{32\;\text{t}}{x}$,$\frac{128}{272}=\frac{32\;\text{t}}{y}$
解得:x=28 t,y=68 t。
则每月消耗含CaO为70%的原料质量为$\frac{28\;\text{t}}{70\%}$=40 t。
答:每月消耗含CaO为70%的原料质量是40 t。
(3)每月得到的硫酸钙可获得的价值为68 t×500元/t=34000元。
答:每月得到的硫酸钙可获得的价值为34000元。
9. (保定唐县期末)某同学为了测定鸡蛋壳中碳酸钙的质量分数,称取 $ 25 \ \text{g} $ 洗净、粉碎后的鸡蛋壳样品放于烧杯中,向烧杯中滴加稀盐酸(不考虑盐酸的挥发和气体的溶解,鸡蛋壳中其他成分不与稀盐酸反应),烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示。问:
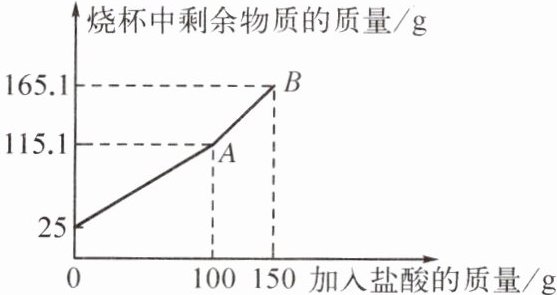
(1) 加入 $ 100 \ \text{g} $ 稀盐酸后鸡蛋壳中的碳酸钙是否完全反应?
(2) 鸡蛋壳中碳酸钙的质量分数。
产生CO₂的总质量为25.0 g+150 g-165.1 g=9.9 g。
解:设鸡蛋壳中碳酸钙的质量分数为x。
CaCO₃+2HCl$\xlongequal{\;\;}$CaCl₂+CO₂↑+H₂O
100 44
25 g×x 9.9 g
$\frac{100}{44}=\frac{25\;\text{g}×x}{9.9\;\text{g}}$
解得:x=90%。
答:鸡蛋壳中碳酸钙的质量分数为90%。

(1) 加入 $ 100 \ \text{g} $ 稀盐酸后鸡蛋壳中的碳酸钙是否完全反应?
是
。(2) 鸡蛋壳中碳酸钙的质量分数。
产生CO₂的总质量为25.0 g+150 g-165.1 g=9.9 g。
解:设鸡蛋壳中碳酸钙的质量分数为x。
CaCO₃+2HCl$\xlongequal{\;\;}$CaCl₂+CO₂↑+H₂O
100 44
25 g×x 9.9 g
$\frac{100}{44}=\frac{25\;\text{g}×x}{9.9\;\text{g}}$
解得:x=90%。
答:鸡蛋壳中碳酸钙的质量分数为90%。
答案:
(1)是
(2)产生CO₂的总质量为25.0 g+150 g-165.1 g=9.9 g。
解:设鸡蛋壳中碳酸钙的质量分数为x。
CaCO₃+2HCl$\xlongequal{\;\;}$CaCl₂+CO₂↑+H₂O
100 44
25 g×x 9.9 g
$\frac{100}{44}=\frac{25\;\text{g}×x}{9.9\;\text{g}}$
解得:x=90%。
答:鸡蛋壳中碳酸钙的质量分数为90%。
提示:
(1)在加入100 g稀盐酸后,再次加入50 g稀盐酸,烧杯中剩余物质的质量也增加了50 g,所以加入100 g稀盐酸后鸡蛋壳中的碳酸钙已完全反应。
(2)产生CO₂的总质量为25.0 g+150 g-165.1 g=9.9 g。
解:设鸡蛋壳中碳酸钙的质量分数为x。
CaCO₃+2HCl$\xlongequal{\;\;}$CaCl₂+CO₂↑+H₂O
100 44
25 g×x 9.9 g
$\frac{100}{44}=\frac{25\;\text{g}×x}{9.9\;\text{g}}$
解得:x=90%。
答:鸡蛋壳中碳酸钙的质量分数为90%。
提示:
(1)在加入100 g稀盐酸后,再次加入50 g稀盐酸,烧杯中剩余物质的质量也增加了50 g,所以加入100 g稀盐酸后鸡蛋壳中的碳酸钙已完全反应。
10. (镇江期末节选)铜锈成分的确定。
【查阅资料】
①铜锈的主要成分可以看成是 $ a{Cu(OH)_{2}} \cdot b{CuCO_{3}} $。
②$ {Cu(OH)_{2}} $、$ {CuCO_{3}} $ 受热易分解,各生成对应的两种氧化物。
③$ {Cu(OH)_{2}} $ 的分解温度为 $ 66 \ \unit{^{\circ}C} \sim 68 \ \unit{^{\circ}C} $,$ {CuCO_{3}} $ 的分解温度为 $ 200 \ \unit{^{\circ}C} \sim 220 \ \unit{^{\circ}C} $。
小组同学用热分析仪对 $ a{Cu(OH)_{2}} \cdot b{CuCO_{3}} $ 固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如下图所示,请根据图示回答下列问题:
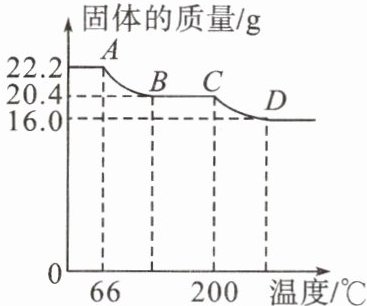
(1) 写出 $ AB $、$ CD $ 段发生反应的化学方程式。
$ AB $ 段:
$ CD $ 段:
(2) $ BC $ 段固体为
(3) 通过计算可得 $ a:b = $
(4) 若将 $ 16.0 \ \text{g} $ 剩余固体继续加热到更高的温度,发现固体质量减少了 $ 1.6 \ \text{g} $ 后质量不再改变,写出此过程中可能发生反应的化学方程式:
【查阅资料】
①铜锈的主要成分可以看成是 $ a{Cu(OH)_{2}} \cdot b{CuCO_{3}} $。
②$ {Cu(OH)_{2}} $、$ {CuCO_{3}} $ 受热易分解,各生成对应的两种氧化物。
③$ {Cu(OH)_{2}} $ 的分解温度为 $ 66 \ \unit{^{\circ}C} \sim 68 \ \unit{^{\circ}C} $,$ {CuCO_{3}} $ 的分解温度为 $ 200 \ \unit{^{\circ}C} \sim 220 \ \unit{^{\circ}C} $。
小组同学用热分析仪对 $ a{Cu(OH)_{2}} \cdot b{CuCO_{3}} $ 固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如下图所示,请根据图示回答下列问题:

(1) 写出 $ AB $、$ CD $ 段发生反应的化学方程式。
$ AB $ 段:
Cu(OH)₂$\xlongequal{\triangle }$CuO+H₂O
;$ CD $ 段:
CuCO₃$\xlongequal{\triangle }$CuO+CO₂↑
。(2) $ BC $ 段固体为
CuO、CuCO₃
。(3) 通过计算可得 $ a:b = $
1:1
。(4) 若将 $ 16.0 \ \text{g} $ 剩余固体继续加热到更高的温度,发现固体质量减少了 $ 1.6 \ \text{g} $ 后质量不再改变,写出此过程中可能发生反应的化学方程式:
4CuO$\xlongequal{\triangle }$2Cu₂O+O₂↑
。
答案:
(1)Cu(OH)₂$\xlongequal{\triangle }$CuO+H₂O CuCO₃$\xlongequal{\triangle }$CuO+CO₂↑ (2)CuO、CuCO₃
(3)1:1 (4)4CuO$\xlongequal{\triangle }$2Cu₂O+O₂↑ 提示:
(1)Cu(OH)₂的分解温度为66℃~68℃,生成的两种氧化物是氧化铜和水;CuCO₃的分解温度为200℃~220℃,生成的两种氧化物是氧化铜和二氧化碳。(2)Cu(OH)₂的分解温度比CuCO₃的分解温度低,受热时氢氧化铜先分解,所以BC段氢氧化铜已经完全分解,固体是反应生成的氧化铜以及还没有分解的碳酸铜。(3)AB段减少的是水的质量,设氢氧化铜的质量为x。
Cu(OH)₂$\xlongequal{\triangle }$CuO+H₂O
98 18
x 22.2 g-20.4 g
$\frac{98}{18}=\frac{x}{22.2\;\text{g}-20.4\;\text{g}}$
解得:x=9.8 g。
CD段减少的是二氧化碳的质量,设碳酸铜的质量为y。
CuCO₃$\xlongequal{\triangle }$CuO+CO₂↑
124 44
y 20.4 g-16.0 g
$\frac{124}{44}=\frac{y}{20.4\;\text{g}-16.0\;\text{g}}$
解得:y=12.4 g。
$\frac{9.8\;\text{g}}{12.4\;\text{g}}=\frac{98a}{124b}$
解得:a:b=1:1。
(4)氧化铜加热后质量又会减少,应该是氧化铜中的氧元素转化为氧气;16 g氧化铜中氧元素的质量为16 g×($\frac{16}{80}$×100%)=3.2 g>1.6 g,说明是氧化铜中的部分氧元素转化为氧气;反应后固体中含有铜元素和氧元素,则反应后固体中铜、氧元素的原子个数比为$\frac{16\;\text{g}-3.2\;\text{g}}{64}:\frac{3.2\;\text{g}-1.6\;\text{g}}{16}$=2:1,所以反应后固体的化学式为Cu₂O,故发生反应的化学方程式为4CuO$\xlongequal{\triangle }$2Cu₂O+O₂↑。
(3)1:1 (4)4CuO$\xlongequal{\triangle }$2Cu₂O+O₂↑ 提示:
(1)Cu(OH)₂的分解温度为66℃~68℃,生成的两种氧化物是氧化铜和水;CuCO₃的分解温度为200℃~220℃,生成的两种氧化物是氧化铜和二氧化碳。(2)Cu(OH)₂的分解温度比CuCO₃的分解温度低,受热时氢氧化铜先分解,所以BC段氢氧化铜已经完全分解,固体是反应生成的氧化铜以及还没有分解的碳酸铜。(3)AB段减少的是水的质量,设氢氧化铜的质量为x。
Cu(OH)₂$\xlongequal{\triangle }$CuO+H₂O
98 18
x 22.2 g-20.4 g
$\frac{98}{18}=\frac{x}{22.2\;\text{g}-20.4\;\text{g}}$
解得:x=9.8 g。
CD段减少的是二氧化碳的质量,设碳酸铜的质量为y。
CuCO₃$\xlongequal{\triangle }$CuO+CO₂↑
124 44
y 20.4 g-16.0 g
$\frac{124}{44}=\frac{y}{20.4\;\text{g}-16.0\;\text{g}}$
解得:y=12.4 g。
$\frac{9.8\;\text{g}}{12.4\;\text{g}}=\frac{98a}{124b}$
解得:a:b=1:1。
(4)氧化铜加热后质量又会减少,应该是氧化铜中的氧元素转化为氧气;16 g氧化铜中氧元素的质量为16 g×($\frac{16}{80}$×100%)=3.2 g>1.6 g,说明是氧化铜中的部分氧元素转化为氧气;反应后固体中含有铜元素和氧元素,则反应后固体中铜、氧元素的原子个数比为$\frac{16\;\text{g}-3.2\;\text{g}}{64}:\frac{3.2\;\text{g}-1.6\;\text{g}}{16}$=2:1,所以反应后固体的化学式为Cu₂O,故发生反应的化学方程式为4CuO$\xlongequal{\triangle }$2Cu₂O+O₂↑。
查看更多完整答案,请扫码查看


