第56页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
7. 如图所示,将白磷和红磷分装于Y形试管的两个支管中,管口套一小气球。将两个支管同时伸入相同深度的热水中,可观察到a处的白磷燃烧,b处的红磷及c处的白磷均不燃烧。

(1) 比较a、b处的现象可以得出燃烧的条件之一是
(2) 管口的小气球可以防止生成的
(3) 实验结束,Y形管充分冷却后,观察到气球比放入热水前更瘪,其原因是

(1) 比较a、b处的现象可以得出燃烧的条件之一是
温度达到可燃物的着火点
。(2) 管口的小气球可以防止生成的
五氧化二磷
进入空气,使该实验绿色化。(3) 实验结束,Y形管充分冷却后,观察到气球比放入热水前更瘪,其原因是
白磷燃烧消耗了其中的氧气
。
答案:
(1)温度达到可燃物的着火点
(2)五氧化二磷
(3)白磷燃烧消耗了其中的氧气
(1)温度达到可燃物的着火点
(2)五氧化二磷
(3)白磷燃烧消耗了其中的氧气
8. (承德双桥月考)某科学兴趣小组的同学设计了三个实验装置(托盘天平略)来验证质量守恒定律,如图A、B、C所示。
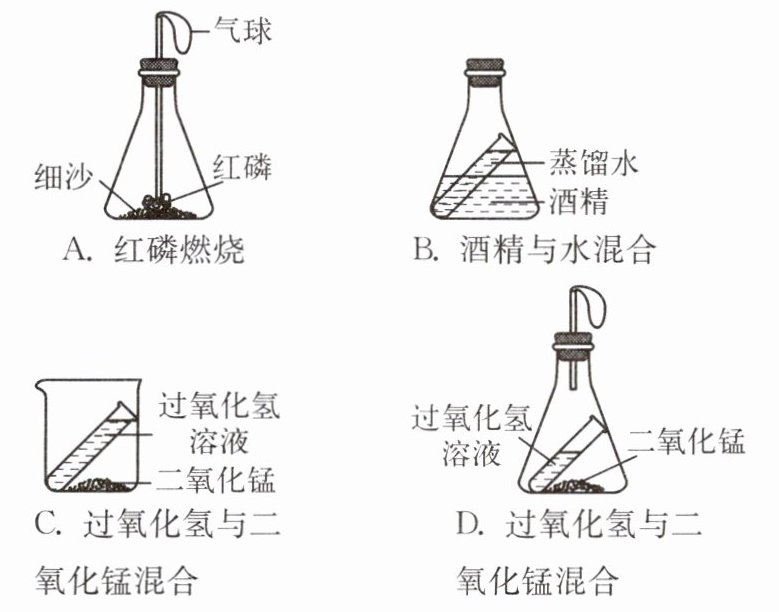
(1) 只有A装置能用来验证质量守恒定律,B、C装置不能。否定B、C装置的理由分别是
(2) A装置中用红热的玻璃管的作用:
(3) 小明受到A装置的启发,将C装置进行改进,如图D所示,此实验的现象是
实验反思:探究或验证反应物与生成物的质量关系时,若要用到有气体参加或有气体生成的反应,反应必须在

(1) 只有A装置能用来验证质量守恒定律,B、C装置不能。否定B、C装置的理由分别是
酒精和水不能反应
、反应生成的氧气逸出装置
。(2) A装置中用红热的玻璃管的作用:
引燃红磷
,实验现象:红磷燃烧,产生白烟
,放出大量热。实验时若取用红磷的量不足,对实验的结果没有
(填“有”或“没有”)影响。写出红磷燃烧的化学方程式:4P+5O₂$\frac{\underline{\;点燃\;}}{}$2P₂O₅
,实验过程中观察到气球的变化现象是先胀大,后慢慢变瘪,气球先胀大的原因是红磷燃烧放热,导致气体膨胀
。(3) 小明受到A装置的启发,将C装置进行改进,如图D所示,此实验的现象是
产生气泡,气球膨胀
,反应的化学方程式:2H₂O₂$\frac{\underline{\;MnO₂\;}}{}$2H₂O+O₂↑
,该装置中小气球的作用是平衡气压,防止瓶塞飞出
。实验反思:探究或验证反应物与生成物的质量关系时,若要用到有气体参加或有气体生成的反应,反应必须在
密封
的容器中进行。
答案:
(1)酒精和水不能反应 反应生成的氧气逸出装置
(2)引燃红磷 白烟 没有4P+5O₂$\frac{\underline{\;点燃\;}}{}$2P₂O₅ 红磷燃烧放热,导致气体膨胀
(3)产生气泡,气球膨胀 2H₂O₂$\frac{\underline{\;MnO₂\;}}{}$2H₂O+O₂↑ 平衡气压,防止瓶塞飞出 密封
(1)酒精和水不能反应 反应生成的氧气逸出装置
(2)引燃红磷 白烟 没有4P+5O₂$\frac{\underline{\;点燃\;}}{}$2P₂O₅ 红磷燃烧放热,导致气体膨胀
(3)产生气泡,气球膨胀 2H₂O₂$\frac{\underline{\;MnO₂\;}}{}$2H₂O+O₂↑ 平衡气压,防止瓶塞飞出 密封
9. 为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水)。有关实验数据如下表所示:
|实验数据|反应前|反应后|
|烧杯和稀盐酸的质量|160g| |
|石灰石样品的质量|12g| |
|烧杯和其中混合物的质量| |167.6g|
求该石灰石中碳酸钙的质量分数。
|实验数据|反应前|反应后|
|烧杯和稀盐酸的质量|160g| |
|石灰石样品的质量|12g| |
|烧杯和其中混合物的质量| |167.6g|
求该石灰石中碳酸钙的质量分数。
答案:
生成二氧化碳的质量为160g+12g-167.6g=4.4g。
解:设该石灰石样品中碳酸钙的质量为x。
CaCO₃+2HCl$\xlongequal{\;\;}$CaCl₂+H₂O+CO₂↑
100 44
x 4.4g
$\frac{100}{44}$=$\frac{x}{4.4g}$
解得:x=10g。
该石灰石中碳酸钙的质量分数为$\frac{10g}{12g}$×100%≈83.3%。
答:该石灰石中碳酸钙的质量分数为83.3%。
解:设该石灰石样品中碳酸钙的质量为x。
CaCO₃+2HCl$\xlongequal{\;\;}$CaCl₂+H₂O+CO₂↑
100 44
x 4.4g
$\frac{100}{44}$=$\frac{x}{4.4g}$
解得:x=10g。
该石灰石中碳酸钙的质量分数为$\frac{10g}{12g}$×100%≈83.3%。
答:该石灰石中碳酸钙的质量分数为83.3%。
查看更多完整答案,请扫码查看


