第31页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
1. 正电子、负质子等都是反粒子。它们与通常所说的电子、质子相比较,质量相等但电性相反。科学家设想在宇宙中可能存在完全由反粒子构成的物质——反物质;物质与反物质相遇会产生“湮灭”现象,释放出巨大的能量,在能源研究领域中前景可观。请你推测,反氢原子的结构可能是 (
A.由一个带正电荷的质子和一个带负电荷的电子构成的
B.由一个带负电荷的质子和一个带正电荷的电子构成的
C.由一个带正电荷的质子和一个带正电荷的电子构成的
D.由一个带负电荷的质子和一个带负电荷的电子构成的
B
)A.由一个带正电荷的质子和一个带负电荷的电子构成的
B.由一个带负电荷的质子和一个带正电荷的电子构成的
C.由一个带正电荷的质子和一个带正电荷的电子构成的
D.由一个带负电荷的质子和一个带负电荷的电子构成的
答案:
B
2. 据科学家预测,月球的土壤中吸附着百万吨的氦(He-3),其原子核中质子数为 2、中子数为 1,每百吨氦(He-3)核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于氦(He-3)元素的说法正确的是 (
A.原子核外电子数为 3
B.相对原子质量为 2
C.原子结构示意图为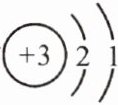
D.原子结构示意图为
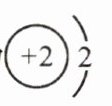
D
)A.原子核外电子数为 3
B.相对原子质量为 2
C.原子结构示意图为
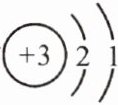
D.原子结构示意图为
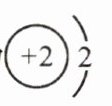
答案:
D
3. (绵阳游仙月考)质量相同的 CO、$N_2、$$SO_2、$$CO_2$四种物质中,含分子数最少的是(
A.CO
B.N_2$$
C.SO_2$$
$D.CO_2$
C
)A.CO
B.N_2$$
C.SO_2$$
$D.CO_2$
答案:
C 提示:质量相同时,相对分子质量越大,分子数越少。CO、N₂、SO₂、CO₂四种物质的相对分子质量分别为28、28、64、44,故分子数由多到少的顺序是CO=N₂>CO₂>SO₂。
4. (常州中考)已知某氧原子的实际质量为 m g,其相对原子质量为 16。有一种铕(Eu)原子的相对原子质量为 152,铕(Eu)原子的质量为 (
A.$\frac {152m}{16}g$
B.$\frac {152m}{16}$
C.$\frac {152m}{12}g$
D.$\frac {152m}{12}$
A
)A.$\frac {152m}{16}g$
B.$\frac {152m}{16}$
C.$\frac {152m}{12}g$
D.$\frac {152m}{12}$
答案:
A 提示:设铕原子的质量为x,则$\frac{m\ \text{g}}{x}=\frac{16}{152}$,解得$x=\frac{152m}{16}\ \text{g}$。
5. (连云港海州期中改编)氢气和氧气在 Pd 基催化剂的表面可反应生成过氧化氢,其微观示意图如下。下列说法不正确的是 (
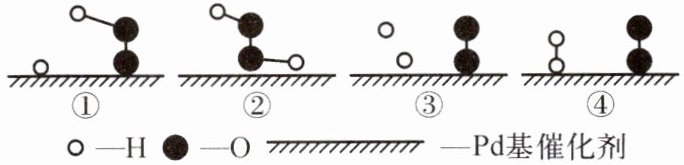
A.生成过氧化氢的微观过程的顺序是④③①②
B.过程③中,氧分子的结构被破坏
C.该过程中原子种类和数目不变
D.该过程可以说明分子可以分成原子
B
)
A.生成过氧化氢的微观过程的顺序是④③①②
B.过程③中,氧分子的结构被破坏
C.该过程中原子种类和数目不变
D.该过程可以说明分子可以分成原子
答案:
B 提示:化学反应的实质是分子分解成原子,原子又重新组合成新分子,根据微观示意图可知,生成过氧化氢的微观过程顺序是④③①②;过程③中,只有氢气分子分解成原子,氧气分子没有变化;化学反应前后原子种类和数目不变;反应过程中氢分子分成了氢原子,所以该过程可以说明分子可以分解成原子。
6. (济南长清期末改编)根据给出的微观结构图,下列说法不正确的是 (
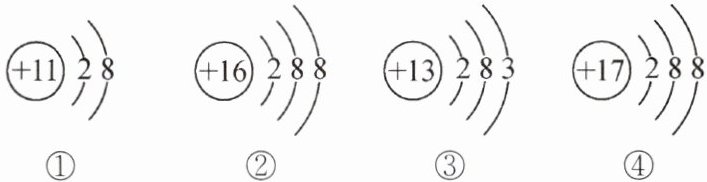
A.①的化学性质比较稳定
B.②④属于同一种离子
C.③属于金属原子
D.③容易失去电子
B
)
A.①的化学性质比较稳定
B.②④属于同一种离子
C.③属于金属原子
D.③容易失去电子
答案:
B 提示:②为S²⁻,④为Cl⁻,不是同一种离子。
7. 原子或离子半径大小比较的一般方法:电子层数越多,半径越大;若电子层数相同,则核电荷数越大,半径越小;若电子层数和核电荷数均相同,则最外层电子数越多,半径越大。
(1) 有下列三种微粒,用字母填空。
①属于阳离子的是
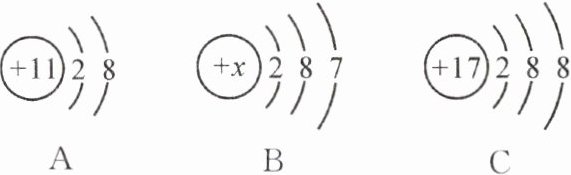
②易得到电子形成阴离子的是
③属于同种元素的是
④半径由大到小的顺序是
(2) 对金属元素来说,原子半径越大,最外层电子数越少,金属性越强,其对应的氢氧化物碱性越强,对应的阳离子的氧化性越弱。现有 Na、Mg、K( )三种金属。
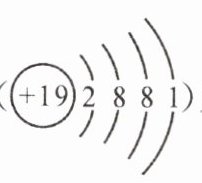
①NaOH、$Mg(OH)_2、$KOH 中碱性最强的是
②Na⁺、$Mg^2⁺、$K⁺中氧化性最强的是
(1) 有下列三种微粒,用字母填空。
①属于阳离子的是
A
。
②易得到电子形成阴离子的是
B
。③属于同种元素的是
BC
。④半径由大到小的顺序是
CBA
。(2) 对金属元素来说,原子半径越大,最外层电子数越少,金属性越强,其对应的氢氧化物碱性越强,对应的阳离子的氧化性越弱。现有 Na、Mg、K( )三种金属。

①NaOH、$Mg(OH)_2、$KOH 中碱性最强的是
KOH
。②Na⁺、$Mg^2⁺、$K⁺中氧化性最强的是
Mg²⁺
。
答案:
(1)①A ②B ③BC ④CBA
(2)①KOH ②Mg²⁺ 提示:
(2)Na、Mg电子层数相同,核电荷数越大,半径越小,则Na原子的半径比Mg原子的半径大;电子层数越多,半径越大,则K原子的半径最大;则三种原子半径由大到小的顺序是K、Na、Mg;对金属元素来说,原子半径越大,最外层电子数越少,金属性越强,对应的氢氧化物碱性越强,对应的阳离子的氧化性越弱,则NaOH、Mg(OH)₂、KOH中碱性最强的是KOH,Na⁺、Mg²⁺、K⁺中氧化性最强的是Mg²⁺。
(1)①A ②B ③BC ④CBA
(2)①KOH ②Mg²⁺ 提示:
(2)Na、Mg电子层数相同,核电荷数越大,半径越小,则Na原子的半径比Mg原子的半径大;电子层数越多,半径越大,则K原子的半径最大;则三种原子半径由大到小的顺序是K、Na、Mg;对金属元素来说,原子半径越大,最外层电子数越少,金属性越强,对应的氢氧化物碱性越强,对应的阳离子的氧化性越弱,则NaOH、Mg(OH)₂、KOH中碱性最强的是KOH,Na⁺、Mg²⁺、K⁺中氧化性最强的是Mg²⁺。
查看更多完整答案,请扫码查看


