第8页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
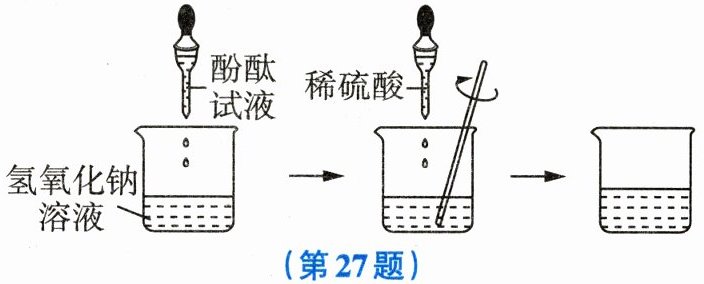
27. (6分) 研究酸与碱之间发生反应的过程时,向装有200g氢氧化钠溶液的烧杯中先滴入几滴酚酞试液,再逐滴加入49g 20%的稀硫酸,边滴边搅拌,两者恰好完全反应,如图所示。
(1) 酸与碱反应的实质是
(2) 计算所得溶液的溶质质量分数。
(3) 查阅资料:已知使酚酞试液变红的pH范围是8.2~10.0。若溶液的颜色刚好由红色变为无色,则此时溶液中存在的离子有
(1) 酸与碱反应的实质是
氢离子和氢氧根离子结合成水分子
。(2) 计算所得溶液的溶质质量分数。
设生成硫酸钠的质量为x。2NaOH+H₂SO₄===Na₂SO₄+2H₂O 98 142 49g×20% x 98/142 = 49g×20%/x,解得x=14.2g。所得溶液的溶质质量分数为14.2g/(200g+49g)×100%≈5.7%。
(3) 查阅资料:已知使酚酞试液变红的pH范围是8.2~10.0。若溶液的颜色刚好由红色变为无色,则此时溶液中存在的离子有
钠离子、硫酸根离子和氢氧根离子
(填离子名称)。
答案:
(1)氢离子和氢氧根离子结合成水分子
(2)设生成硫酸钠的质量为x。2NaOH+H₂SO₄===Na₂SO₄+2H₂O 98 142 49g×20% x 98/142 = 49g×20%/x,解得x=14.2g。所得溶液的溶质质量分数为14.2g/(200g+49g)×100%≈5.7%。
(3)钠离子、硫酸根离子和氢氧根离子
(1)氢离子和氢氧根离子结合成水分子
(2)设生成硫酸钠的质量为x。2NaOH+H₂SO₄===Na₂SO₄+2H₂O 98 142 49g×20% x 98/142 = 49g×20%/x,解得x=14.2g。所得溶液的溶质质量分数为14.2g/(200g+49g)×100%≈5.7%。
(3)钠离子、硫酸根离子和氢氧根离子
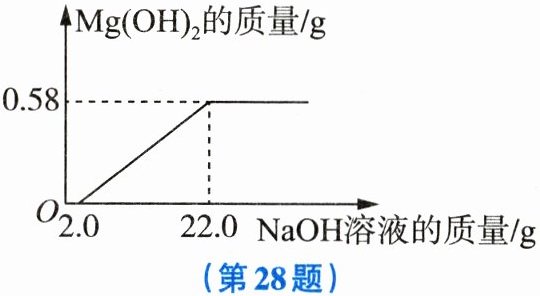
28. (6分$) Mg(OH)_2$有广泛的应用,常用菱镁矿来制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂,过滤,得到只含$MgSO_4$和$H_2SO_4$的混合溶液。为确定混合溶液中$MgSO_4$的含量,现取混合溶液100g,再逐滴加入一定溶质质量分数的NaOH溶液30g,产生$Mg(OH)_2$沉淀的质量如图所示。
(1) 实验开始时,并未立即生成$Mg(OH)_2$沉淀的原因是
(2) 充分反应后,最终溶液中的溶质是
(3) 计算100g混合溶液中$MgSO_4$的质量。
(1) 实验开始时,并未立即生成$Mg(OH)_2$沉淀的原因是
氢氧化钠先与硫酸反应,后与硫酸镁反应生成氢氧化镁沉淀和硫酸钠
。(2) 充分反应后,最终溶液中的溶质是
硫酸钠、氢氧化钠(或Na₂SO₄、NaOH)
。(3) 计算100g混合溶液中$MgSO_4$的质量。

答案:
(1)氢氧化钠先与硫酸反应,后与硫酸镁反应生成氢氧化镁沉淀和硫酸钠
(2)硫酸钠、氢氧化钠(或Na₂SO₄、NaOH)
(3)设100g混合溶液中含MgSO₄的质量为x。MgSO₄+2NaOH===Mg(OH)₂↓+Na₂SO₄ 120 58 x 0.58g 120/58 = x/0.58g,解得x=1.2g。即100g混合溶液中MgSO₄的质量为1.2g。
(1)氢氧化钠先与硫酸反应,后与硫酸镁反应生成氢氧化镁沉淀和硫酸钠
(2)硫酸钠、氢氧化钠(或Na₂SO₄、NaOH)
(3)设100g混合溶液中含MgSO₄的质量为x。MgSO₄+2NaOH===Mg(OH)₂↓+Na₂SO₄ 120 58 x 0.58g 120/58 = x/0.58g,解得x=1.2g。即100g混合溶液中MgSO₄的质量为1.2g。
29. (6分) 在一定量的氢氧化钠稀溶液中逐滴加入溶质质量分数为0.73%的稀盐酸,反应过程中不断搅拌并及时测量不同时刻溶液的温度与pH,记录数据如下表所示。
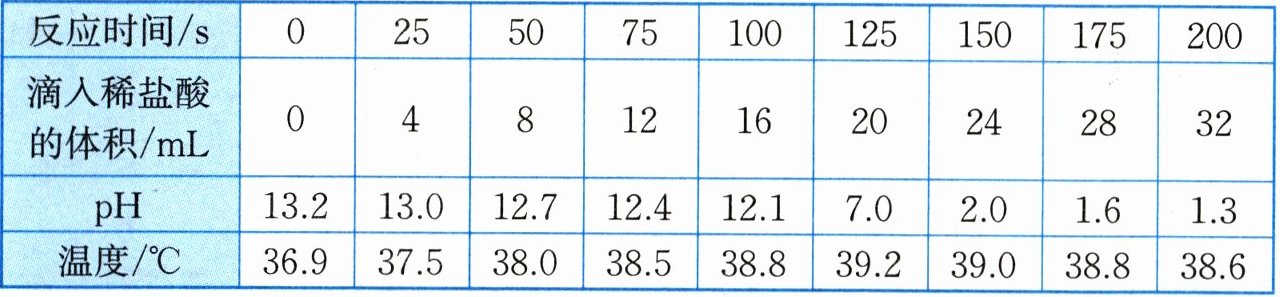
(1) 观察上表发现,当反应进行
(2) 分析上表中的数据发现,在逐滴加入稀盐酸的过程中,溶液的温度先升高后降低,请分析原因:
(3) 结合表中滴入稀盐酸的体积与pH的变化数据,试计算氢氧化钠稀溶液中溶质的质量。(稀盐酸的密度取1.0g/mL)

(1) 观察上表发现,当反应进行
125
s时,氢氧化钠与稀盐酸恰好完全中和。(2) 分析上表中的数据发现,在逐滴加入稀盐酸的过程中,溶液的温度先升高后降低,请分析原因:
中和反应是放热反应,随着稀盐酸的量增加,放出的热量增大,从而使溶液的温度上升;过量的稀盐酸起冷却降温作用,同时反应停止,热量散失,所以温度又会下降
。(3) 结合表中滴入稀盐酸的体积与pH的变化数据,试计算氢氧化钠稀溶液中溶质的质量。(稀盐酸的密度取1.0g/mL)
据表可知,当恰好完全反应时,用去稀盐酸的体积为20mL。HCl的质量为20mL×1.0g/mL×0.73%=0.146g,设氢氧化钠溶液中溶质的质量为x。NaOH+HCl===NaCl+H₂O 40 36.5 x 0.146g 40/36.5 = x/0.146g,解得x=0.16g。
答案:
(1)125
(2)中和反应是放热反应,随着稀盐酸的量增加,放出的热量增大,从而使溶液的温度上升;过量的稀盐酸起冷却降温作用,同时反应停止,热量散失,所以温度又会下降
(3)据表可知,当恰好完全反应时,用去稀盐酸的体积为20mL。HCl的质量为20mL×1.0g/mL×0.73%=0.146g,设氢氧化钠溶液中溶质的质量为x。NaOH+HCl===NaCl+H₂O 40 36.5 x 0.146g 40/36.5 = x/0.146g,解得x=0.16g。
(1)125
(2)中和反应是放热反应,随着稀盐酸的量增加,放出的热量增大,从而使溶液的温度上升;过量的稀盐酸起冷却降温作用,同时反应停止,热量散失,所以温度又会下降
(3)据表可知,当恰好完全反应时,用去稀盐酸的体积为20mL。HCl的质量为20mL×1.0g/mL×0.73%=0.146g,设氢氧化钠溶液中溶质的质量为x。NaOH+HCl===NaCl+H₂O 40 36.5 x 0.146g 40/36.5 = x/0.146g,解得x=0.16g。
30. (6分) 某科学兴趣小组的同学为了测定大理石中碳酸钙的含量,进行如图甲所示的实验,将过量的稀盐酸加入20g大理石中(其他成分不与盐酸反应),把产生的$CO_2$气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如表所示。
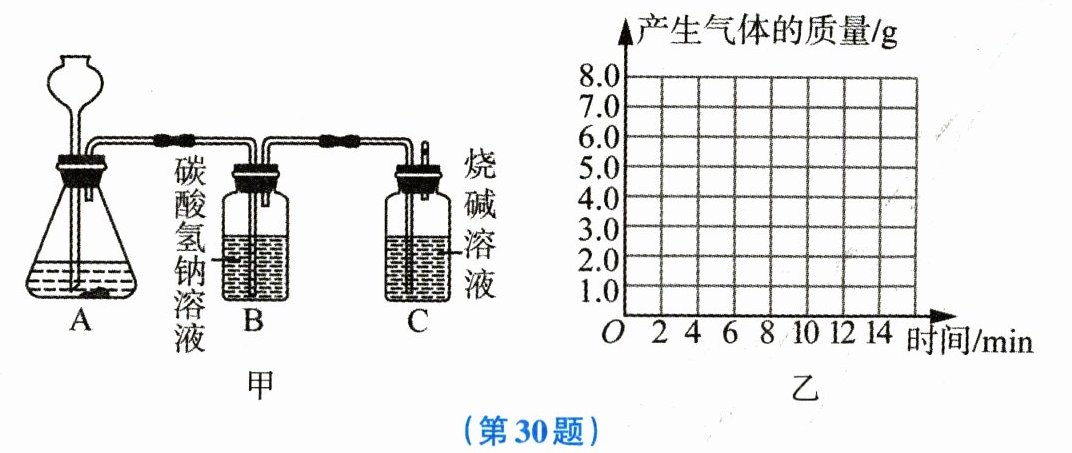

(1) 上表中,第10min时,x= ______。
(2) 计算大理石样品中碳酸钙的质量分数。
(3) 请在如图乙所示的坐标系中,以时间为横坐标,以产生$CO_2$气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线。


(1) 上表中,第10min时,x= ______。
(2) 计算大理石样品中碳酸钙的质量分数。
(3) 请在如图乙所示的坐标系中,以时间为横坐标,以产生$CO_2$气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线。
答案:
(1)6.6
(2)设大理石样品中碳酸钙的质量为x。CaCO₃+2HCl===CaCl₂+H₂O+CO₂↑100 44 x 6.6g 100/44 = x/6.6g,解得x=15g。所以大理石样品中碳酸钙的质量分数为15g/20g×100%=75%
(3)如图所示。
(1)6.6
(2)设大理石样品中碳酸钙的质量为x。CaCO₃+2HCl===CaCl₂+H₂O+CO₂↑100 44 x 6.6g 100/44 = x/6.6g,解得x=15g。所以大理石样品中碳酸钙的质量分数为15g/20g×100%=75%
(3)如图所示。

查看更多完整答案,请扫码查看


