第15页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
20. 现有4包白色粉末,编号为A、B、C、D,它们分别是硫酸铜、氯化钠、硝酸钾、氢氧化钠中的某一种,现通过下列实验对其一一进行鉴别。
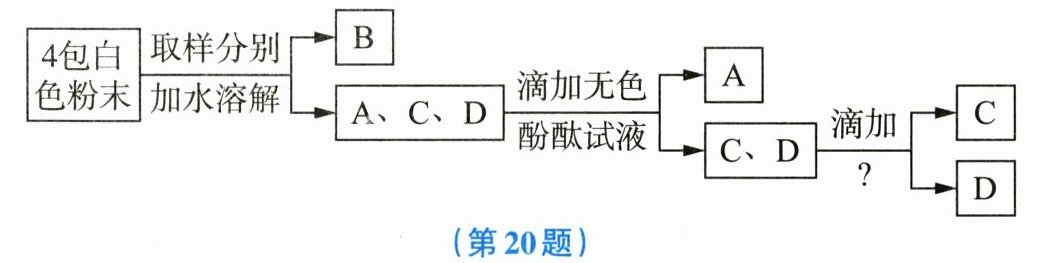
(1)通过实验确定B是硫酸铜,则该试管中看到的现象是
(2)若酚酞试液滴入A溶液中会使A溶液变红色,则A的化学式为
(3)要将C、D鉴别出来,“?”代表的试剂是

(1)通过实验确定B是硫酸铜,则该试管中看到的现象是
溶液呈蓝色
。(2)若酚酞试液滴入A溶液中会使A溶液变红色,则A的化学式为
NaOH
。(3)要将C、D鉴别出来,“?”代表的试剂是
硝酸银溶液
。
答案:
(1)溶液呈蓝色
(2)NaOH
(3)硝酸银溶液
(1)溶液呈蓝色
(2)NaOH
(3)硝酸银溶液
21. 小刚利用自己掌握的知识来探究碳酸钾溶液的酸碱性。
【猜想与假设】猜想一:碳酸钾溶液可能呈中性;猜想二:碳酸钾溶液可能呈碱性;猜想三:碳酸钾溶液可能呈酸性。
【设计与实验】小刚进行了如下实验:
实验一:向盛有适量碳酸钾溶液的试管中滴加几滴紫色石蕊试液,溶液变为蓝色。
实验二:向盛有适量碳酸钾溶液的试管中滴加几滴无色酚酞试液,溶液变为红色。
实验三:测定碳酸钾溶液的pH,具体操作方法是
【结论】以上实验证明碳酸钾溶液呈
【猜想与假设】猜想一:碳酸钾溶液可能呈中性;猜想二:碳酸钾溶液可能呈碱性;猜想三:碳酸钾溶液可能呈酸性。
【设计与实验】小刚进行了如下实验:
实验一:向盛有适量碳酸钾溶液的试管中滴加几滴紫色石蕊试液,溶液变为蓝色。
实验二:向盛有适量碳酸钾溶液的试管中滴加几滴无色酚酞试液,溶液变为红色。
实验三:测定碳酸钾溶液的pH,具体操作方法是
取一张pH试纸放在干燥、洁净的白瓷板或玻璃片上,用干燥、洁净的玻璃棒蘸取碳酸钾溶液,滴在pH试纸上,把试纸显示的颜色与标准比色卡进行比较
,测得pH= 12。【结论】以上实验证明碳酸钾溶液呈
碱
性,说明盐类物质的水溶液不一定呈中性。
答案:
【设计与实验】取一张pH试纸放在干燥、洁净的白瓷板或玻璃片上,用干燥、洁净的玻璃棒蘸取碳酸钾溶液,滴在pH试纸上,把试纸显示的颜色与标准比色卡进行比较 【结论】碱
22. 某兴趣小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了如图所示的实验。请你与他们一起完成以下探究活动。
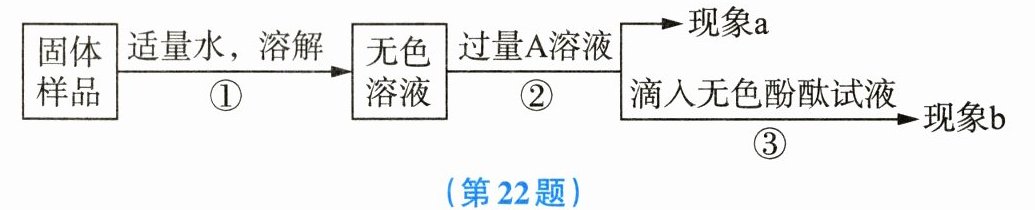
查阅资料:$Na_2CO_3$溶液的pH>7,与稀盐酸反应时有气泡产生,与$Ca(OH)_2$溶液反应时有白色沉淀生成。
对固体的成分进行猜想:Ⅰ. 全部是NaOH;Ⅱ. 全部是$Na_2CO_3;$Ⅲ. 是NaOH和$Na_2CO_3$的混合物。
实验和推断:
(1)若现象a为有气泡产生,则加入的A溶液是
(2)若A溶液是$Ca(OH)_2$溶液,现象a为有白色沉淀产生,现象b为溶液变为红色,则该实验
(3)若A溶液是$CaCl_2$溶液,则当实验现象a、b分别为

查阅资料:$Na_2CO_3$溶液的pH>7,与稀盐酸反应时有气泡产生,与$Ca(OH)_2$溶液反应时有白色沉淀生成。
对固体的成分进行猜想:Ⅰ. 全部是NaOH;Ⅱ. 全部是$Na_2CO_3;$Ⅲ. 是NaOH和$Na_2CO_3$的混合物。
实验和推断:
(1)若现象a为有气泡产生,则加入的A溶液是
稀盐酸
,说明氢氧化钠已经变质。(2)若A溶液是$Ca(OH)_2$溶液,现象a为有白色沉淀产生,现象b为溶液变为红色,则该实验
不能
(填“能”或“不能”)说明样品中有NaOH。(3)若A溶液是$CaCl_2$溶液,则当实验现象a、b分别为
产生白色沉淀、溶液不变色
时,猜想Ⅱ成立。
答案:
(1)稀盐酸
(2)不能
(3)产生白色沉淀、溶液不变色
【解析】
(1)稀盐酸与碳酸钠溶液反应时有气泡产生。
(2)碳酸钠和氢氧化钙反应生成了氢氧化钠,不能说明原溶液中含有氢氧化钠。
(3)氯化钙与碳酸钠反应生成碳酸钙白色沉淀和氯化钠,待碳酸钠全部反应后,溶液呈中性,不能使无色酚酞试液变色。
(1)稀盐酸
(2)不能
(3)产生白色沉淀、溶液不变色
【解析】
(1)稀盐酸与碳酸钠溶液反应时有气泡产生。
(2)碳酸钠和氢氧化钙反应生成了氢氧化钠,不能说明原溶液中含有氢氧化钠。
(3)氯化钙与碳酸钠反应生成碳酸钙白色沉淀和氯化钠,待碳酸钠全部反应后,溶液呈中性,不能使无色酚酞试液变色。
23. 某研究性学习小组对酸和碱之间的反应进行探究。
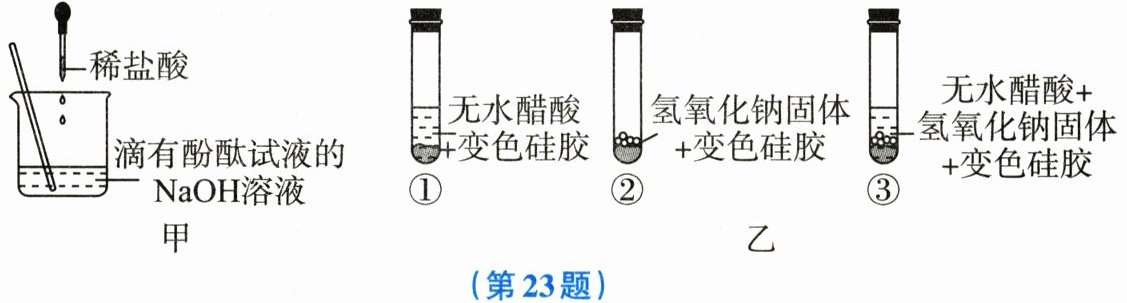
【实验一】证明酸和碱发生了反应。
稀盐酸和NaOH溶液混合没有明显现象,小李按图甲所示,首先向盛有适量NaOH溶液的试管中滴加2~3滴酚酞试液,接着向试管中逐滴加入稀盐酸,当观察到
【实验二】证明酸碱反应有水生成。
小杨取变色硅胶(吸水后由蓝色变为红色)、无水醋酸(一种酸,常温下为无色液体)和氢氧化钠固体进行如图乙所示的三个实验。
(1)实验①、②的目的是
(2)能证明酸和碱反应有水生成的现象是

【实验一】证明酸和碱发生了反应。
稀盐酸和NaOH溶液混合没有明显现象,小李按图甲所示,首先向盛有适量NaOH溶液的试管中滴加2~3滴酚酞试液,接着向试管中逐滴加入稀盐酸,当观察到
溶液由红色变成无色
时,证明稀盐酸和NaOH溶液发生了化学反应。【实验二】证明酸碱反应有水生成。
小杨取变色硅胶(吸水后由蓝色变为红色)、无水醋酸(一种酸,常温下为无色液体)和氢氧化钠固体进行如图乙所示的三个实验。
(1)实验①、②的目的是
对比,证明无水醋酸和氢氧化钠固体都不含水
。(2)能证明酸和碱反应有水生成的现象是
③中变色硅胶由蓝色变为红色
。
答案:
【实验一】溶液由红色变成无色 【实验二】
(1)对比,证明无水醋酸和氢氧化钠固体都不含水
(2)③中变色硅胶由蓝色变为红色
(1)对比,证明无水醋酸和氢氧化钠固体都不含水
(2)③中变色硅胶由蓝色变为红色
24. 某$KNO_3$化肥中可能混入了$NH_4Cl、$$(NH_4)_2SO_4、$$K_2CO_3$三种物质中的一种或几种,同学们取适量该化肥配成溶液A,开展了如图所示的探究活动。
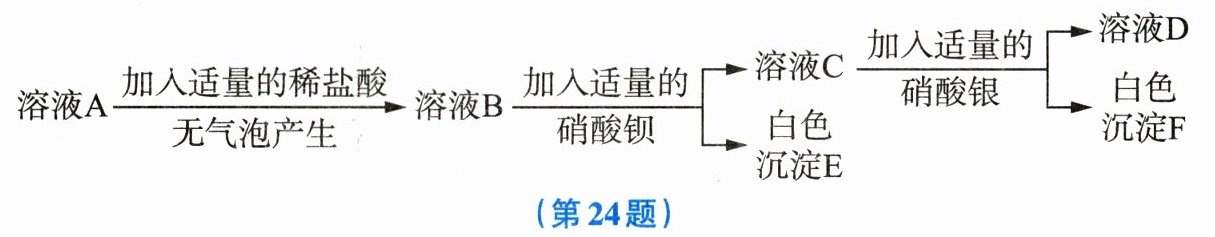
$(1)KNO_3$是一种
(2)加入适量的稀盐酸,无气泡产生,说明该化肥中没有混入
(3)小明通过生成白色沉淀F的现象,认为该化肥中一定混入了$NH_4Cl$和$(NH_4)_2SO_4,$一定没有混入$K_2CO_3。$小强认为这个结论不正确,他的理由是

$(1)KNO_3$是一种
复合
肥。(2)加入适量的稀盐酸,无气泡产生,说明该化肥中没有混入
K₂CO₃
。(3)小明通过生成白色沉淀F的现象,认为该化肥中一定混入了$NH_4Cl$和$(NH_4)_2SO_4,$一定没有混入$K_2CO_3。$小强认为这个结论不正确,他的理由是
检验是否有碳酸钾时加入了稀盐酸,引入了Cl⁻,也会和硝酸银反应产生白色沉淀
。
答案:
(1)复合
(2)K₂CO₃
(3)检验是否有碳酸钾时加入了稀盐酸,引入了Cl⁻,也会和硝酸银反应产生白色沉淀
(1)复合
(2)K₂CO₃
(3)检验是否有碳酸钾时加入了稀盐酸,引入了Cl⁻,也会和硝酸银反应产生白色沉淀
25. 为测量纯碱样品中碳酸钠的质量分数,小金设计了如图甲所示的实验,已知装置气密性良好,样品完全反应,通过称量装置B的质量变化来确定样品中碳酸钠的质量分数(其他杂质不与酸反应)。
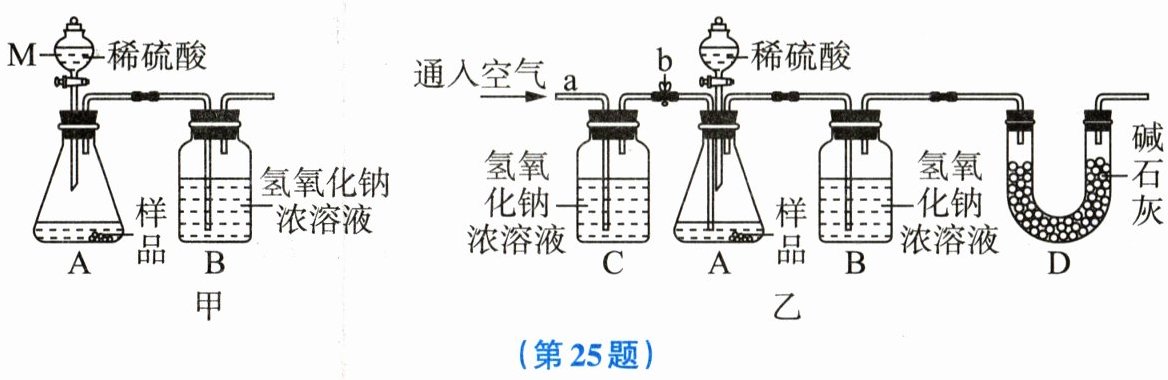
(1)写出图甲中仪器M的名称:
(2)按图甲所示的装置进行多次实验,发现测量结果比实际值偏小,其原因是
(3)小金重新设计了如图乙所示的实验,装置C的作用是
(4)若图乙所示的实验中纯碱样品的质量为m g,反应结束后测得装置B的质量增加了n g,则样品中碳酸钠的质量分数为

(1)写出图甲中仪器M的名称:
分液漏斗
。(2)按图甲所示的装置进行多次实验,发现测量结果比实际值偏小,其原因是
装置A中残留的二氧化碳未被装置B中的氢氧化钠完全吸收
。(3)小金重新设计了如图乙所示的实验,装置C的作用是
除去通入的空气中的二氧化碳
。(4)若图乙所示的实验中纯碱样品的质量为m g,反应结束后测得装置B的质量增加了n g,则样品中碳酸钠的质量分数为
$\frac{53n}{22m}$×100%
。
答案:
(1)分液漏斗
(2)装置A中残留的二氧化碳未被装置B中的氢氧化钠完全吸收
(3)除去通入的空气中的二氧化碳
(4)$\frac{53n}{22m}$×100%
【解析】
(4)设样品中碳酸钠的质量为x。
Na₂CO₃+H₂SO₄===Na₂SO₄+H₂O+CO₂↑
106 44
x ng
$\frac{106}{44}$=$\frac{x}{ng}$,解得x=$\frac{106n}{44}$g。
故纯碱样品中碳酸钠的质量分数为$\frac{\frac{106n}{44}g}{mg}$×100%=$\frac{106n}{44m}$×100%=$\frac{53n}{22m}$×100%。
(1)分液漏斗
(2)装置A中残留的二氧化碳未被装置B中的氢氧化钠完全吸收
(3)除去通入的空气中的二氧化碳
(4)$\frac{53n}{22m}$×100%
【解析】
(4)设样品中碳酸钠的质量为x。
Na₂CO₃+H₂SO₄===Na₂SO₄+H₂O+CO₂↑
106 44
x ng
$\frac{106}{44}$=$\frac{x}{ng}$,解得x=$\frac{106n}{44}$g。
故纯碱样品中碳酸钠的质量分数为$\frac{\frac{106n}{44}g}{mg}$×100%=$\frac{106n}{44m}$×100%=$\frac{53n}{22m}$×100%。
查看更多完整答案,请扫码查看


