第100页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
22. (4 分)某科学兴趣小组的同学为了探究化学反应中的能量变化,进行盐酸与碳酸氢钠溶液的反应实验。如图所示为某同学在 20℃、基本隔热条件下,利用温度传感器分别测定向 20mL 水和 20mL 饱和碳酸氢钠溶液中各倒入 20mL 浓度为 13.7%的盐酸时温度随时间变化的曲线,曲线①为“水 + 13.7%的盐酸”的温度变化曲线,曲线②为“饱和碳酸氢钠溶液 + 13.7%的盐酸”的温度变化曲线。实验测得饱和碳酸氢钠溶液稀释时温度变化不大,可忽略不计。
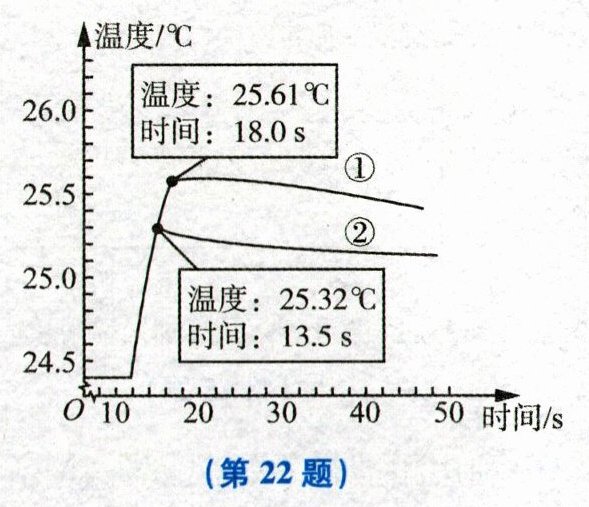
(1)写出盐酸与碳酸氢钠反应的化学方程式:
(2)18s 后,曲线①逐渐下降的原因是
(3)比较曲线①和曲线②,你认为 13.7%的盐酸与饱和碳酸氢钠溶液的反应是

(1)写出盐酸与碳酸氢钠反应的化学方程式:
${NaHCO_{3} + HCl\xlongequal{}NaCl + H_{2}O + CO_{2}\uparrow}$
。(2)18s 后,曲线①逐渐下降的原因是
盐酸浓度很低,不再放热
。(3)比较曲线①和曲线②,你认为 13.7%的盐酸与饱和碳酸氢钠溶液的反应是
放热
(填“放热”或“吸热”)反应,其理由是反应后溶液温度升高
。
答案:
(1)${NaHCO_{3} + HCl\xlongequal{}NaCl + H_{2}O + CO_{2}\uparrow}$
(2)盐酸浓度很低,不再放热
(3)放热 反应后溶液温度升高
(1)${NaHCO_{3} + HCl\xlongequal{}NaCl + H_{2}O + CO_{2}\uparrow}$
(2)盐酸浓度很低,不再放热
(3)放热 反应后溶液温度升高
23. (3 分)分析下列化学方程式表示的反应,回答下列问题:
$①NaOH + NH_4Cl = NaCl + NH_3↑ + H_2O。$
$②2KOH + (NH_4)_2SO_4 = K_2SO_4 + 2NH_3↑ + 2H_2O。$
$③Ca(OH)_2 + 2NH_4NO_3 = Ca(NO_3)_2 + 2NH_3↑ + 2H_2O。$
(1)上述反应中$,NH_4Cl、$$(NH_4)_2SO_4、$$NH_4NO_3 $属于化肥中的
(2)由上述反应可知,碱与铵盐反应的规律是都生成
(3)用熟石灰改良过的土壤不能使用铵盐的原因是
$①NaOH + NH_4Cl = NaCl + NH_3↑ + H_2O。$
$②2KOH + (NH_4)_2SO_4 = K_2SO_4 + 2NH_3↑ + 2H_2O。$
$③Ca(OH)_2 + 2NH_4NO_3 = Ca(NO_3)_2 + 2NH_3↑ + 2H_2O。$
(1)上述反应中$,NH_4Cl、$$(NH_4)_2SO_4、$$NH_4NO_3 $属于化肥中的
氮
肥。(2)由上述反应可知,碱与铵盐反应的规律是都生成
盐、氨气
和水。(3)用熟石灰改良过的土壤不能使用铵盐的原因是
铵盐会与熟石灰反应生成氨气,从而失去肥效
。
答案:
(1)氮
(2)盐、氨气
(3)铵盐会与熟石灰反应生成氨气,从而失去肥效
(1)氮
(2)盐、氨气
(3)铵盐会与熟石灰反应生成氨气,从而失去肥效
24. (3 分)已知某固体粉末是 NaCl、$BaCl_2、$$CuSO_4、$$Na_2SO_4 $中的一种或几种的混合物,为确定其成分,现进行以下实验:①粉末加水,振荡后,呈浑浊,过滤,滤液呈无色;②向滤液中加入$ AgNO_3 $溶液时,产生白色沉淀,继续加入足量的稀$ HNO_3,$沉淀不消失;③将滤出的沉淀加足量的稀 HCl 时,沉淀不消失。原粉末中一定有
${Na_{2}SO_{4}}$、${BaCl_{2}}$
,一定不含有${CuSO_{4}}$
,可能含有${NaCl}$
。
答案:
${Na_{2}SO_{4}}$、${BaCl_{2}}$ ${CuSO_{4}}$ ${NaCl}$
25. (2 分)某无色溶液中可能含有 Na⁺、$Mg^2⁺、$$Fe^3⁺、$Cl⁻、OH⁻、$SO_4^2⁻ $等离子中的一种或几种,经 pH 试纸测定,该溶液的 pH 为 11。由此可知,该溶液中一定存在的阴离子是
${OH^{-}}$
,一定不存在的阳离子是${Mg^{2+}}$、${Fe^{3+}}$
。
答案:
${OH^{-}}$ ${Mg^{2+}}$、${Fe^{3+}}$
26. (6 分)同学们在验证碳酸钠的化学性质时,分别取少量的碳酸钠溶液于四支试管中,做了如图所示的实验。
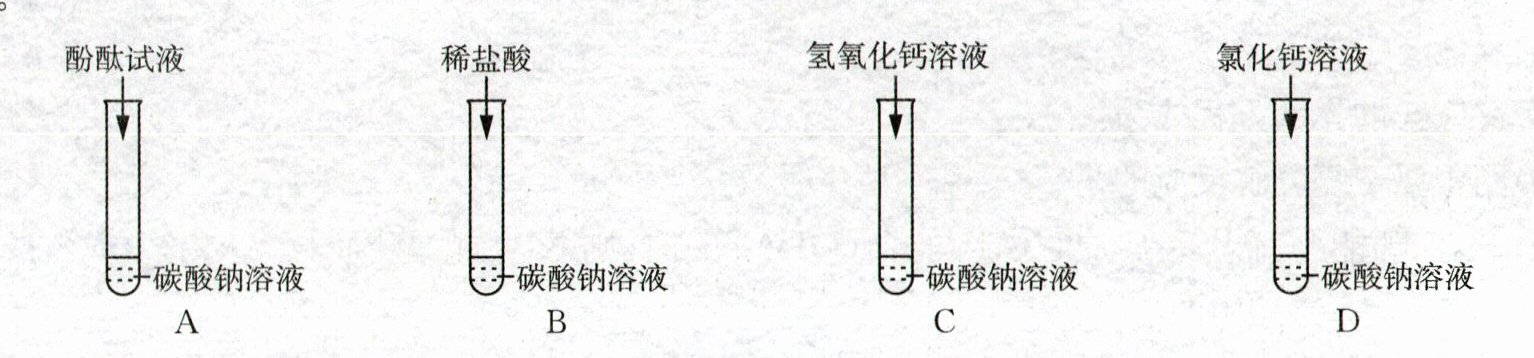
(1)A 试管中溶液变为红色,说明碳酸钠溶液显
(2)B 试管中有气泡产生,发生反应的化学方程式为
(3)C 试管中发生反应的化学方程式为
(4)D 试管中产生的明显现象是
(5)实验结束后,同学们将上述四支试管中的物质倒入同一烧杯内,烧杯底部有白色固体,上层为红色溶液。为了处理废液,将烧杯内混合物过滤后,向红色滤液中加入稀盐酸,有气泡产生,说明滤液中一定没有的溶质为(
A. 氢氧化钠
B. 碳酸钠
C. 氯化钙
D. 氢氧化钙
继续加稀盐酸至溶液颜色恰好变为无色,此时溶液中的溶质为

(1)A 试管中溶液变为红色,说明碳酸钠溶液显
碱
性。(2)B 试管中有气泡产生,发生反应的化学方程式为
${Na_{2}CO_{3} + 2HCl\xlongequal{}2NaCl + H_{2}O + CO_{2}\uparrow}$
。(3)C 试管中发生反应的化学方程式为
${Ca(OH)_{2} + Na_{2}CO_{3}\xlongequal{}CaCO_{3}\downarrow + 2NaOH}$
。(4)D 试管中产生的明显现象是
有白色沉淀生成
。(5)实验结束后,同学们将上述四支试管中的物质倒入同一烧杯内,烧杯底部有白色固体,上层为红色溶液。为了处理废液,将烧杯内混合物过滤后,向红色滤液中加入稀盐酸,有气泡产生,说明滤液中一定没有的溶质为(
CD
)(填字母)。A. 氢氧化钠
B. 碳酸钠
C. 氯化钙
D. 氢氧化钙
继续加稀盐酸至溶液颜色恰好变为无色,此时溶液中的溶质为
NaCl
(酚酞试液除外)。
答案:
(1)碱
(2)${Na_{2}CO_{3} + 2HCl\xlongequal{}2NaCl + H_{2}O + CO_{2}\uparrow}$
(3)${Ca(OH)_{2} + Na_{2}CO_{3}\xlongequal{}CaCO_{3}\downarrow + 2NaOH}$
(4)有白色沉淀生成
(5)CD ${NaCl}$
(1)碱
(2)${Na_{2}CO_{3} + 2HCl\xlongequal{}2NaCl + H_{2}O + CO_{2}\uparrow}$
(3)${Ca(OH)_{2} + Na_{2}CO_{3}\xlongequal{}CaCO_{3}\downarrow + 2NaOH}$
(4)有白色沉淀生成
(5)CD ${NaCl}$
查看更多完整答案,请扫码查看


