第28页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
26. (4分) 将一定量的Fe粉投入含$Cu(NO_{3})_{2}和AgNO_{3}$的溶液中,充分反应后,过滤得到滤渣和滤液,取一定量的滤渣,加入少量稀盐酸,发现部分滤渣溶解并有气泡产生。请说出滤渣和滤液中所含的有效成分,并说明理由。
答案:
滤渣中含有银、铜、铁;滤液中含有硝酸亚铁。理由如下:将一定量的Fe粉投入含Cu(NO₃)₂和AgNO₃的溶液中,铁先和硝酸银反应生成硝酸亚铁和银,后和硝酸铜反应生成硝酸亚铁和铜,充分反应后,过滤得到滤渣和滤液,取一定量的滤渣加入少量稀盐酸,发现部分滤渣溶解并有气泡产生,这是因为稀盐酸和铁反应生成氯化亚铁和氢气,说明滤渣中含有银、铜、铁,即铁过量,故滤液中只含有硝酸亚铁。
27. (6分) 现有一包固体粉末,是$Na_{2}CO_{3}和Na_{2}SO_{4}$的混合物22.2g,向其中加入足量的稀$H_{2}SO_{4}$,产生气体的质量和加入稀$H_{2}SO_{4}$质量的关系如图所示。
(1) 产生气体的质量为
(2) 恰好完全反应时,求所用稀$H_{2}SO_{4}$中溶质的质量。
(3) 求恰好完全反应时溶液的溶质质量分数。
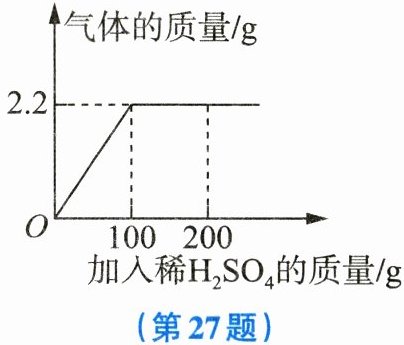
(1) 产生气体的质量为
2.2
g。(2) 恰好完全反应时,求所用稀$H_{2}SO_{4}$中溶质的质量。
(3) 求恰好完全反应时溶液的溶质质量分数。

答案:
(1)2.2
(2)设恰好完全反应时,所用稀H₂SO₄中溶质的质量为x,Na₂CO₃的质量为y,生成Na₂SO₄的质量为z。Na₂CO₃+H₂SO₄===Na₂SO₄+H₂O+CO₂↑106 98 142 44y x z 2.2g$\frac{106}{y}=\frac{98}{x}=\frac{142}{z}=\frac{44}{2.2g}$,解得x=4.9g,y=5.3g,z=7.1g。所用稀H₂SO₄中溶质的质量为4.9g。
(3)溶液中溶质的质量为7.1g+22.2g-5.3g=24g,溶液的总质量为22.2g+100g-2.2g=120g,则Na₂SO₄的质量分数为$\frac{24g}{120g}×100\%=20\%$。
(1)2.2
(2)设恰好完全反应时,所用稀H₂SO₄中溶质的质量为x,Na₂CO₃的质量为y,生成Na₂SO₄的质量为z。Na₂CO₃+H₂SO₄===Na₂SO₄+H₂O+CO₂↑106 98 142 44y x z 2.2g$\frac{106}{y}=\frac{98}{x}=\frac{142}{z}=\frac{44}{2.2g}$,解得x=4.9g,y=5.3g,z=7.1g。所用稀H₂SO₄中溶质的质量为4.9g。
(3)溶液中溶质的质量为7.1g+22.2g-5.3g=24g,溶液的总质量为22.2g+100g-2.2g=120g,则Na₂SO₄的质量分数为$\frac{24g}{120g}×100\%=20\%$。
28. (8分) 现有氧化铜和铜的混合物,某科学兴趣小组准备对其成分进行分析。他们取10g此样品,向其中分五次加入相同质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表。
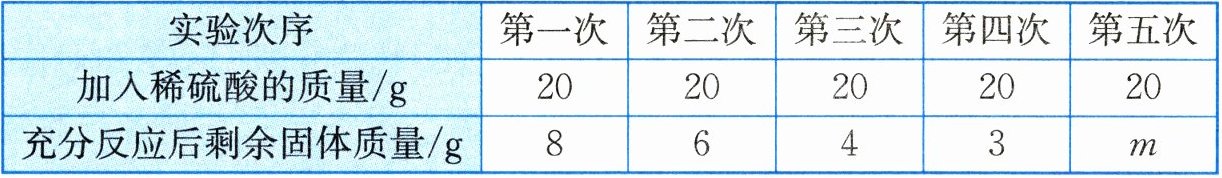
(1) 上表中m的值为
(2) 求混合物中铜的质量分数。
(3) 计算所加入稀硫酸的溶质质量分数。

(1) 上表中m的值为
3
,10g样品中$CuO$的质量为7
g。(2) 求混合物中铜的质量分数。
混合物中铜的质量分数为$\frac{3g}{10g}×100\%=30\%$。
(3) 计算所加入稀硫酸的溶质质量分数。
设20g稀硫酸中溶质的质量为x。CuO+H₂SO₄===CuSO₄+H₂O80 982g x$\frac{80}{98}=\frac{2g}{x}$,解得x=2.45g。加入稀硫酸的溶质质量分数为$\frac{2.45g}{20g}×100\%=12.25\%$。
答案:
(1)3 7
(2)混合物中铜的质量分数为$\frac{3g}{10g}×100\%=30\%$。
(3)设20g稀硫酸中溶质的质量为x。CuO+H₂SO₄===CuSO₄+H₂O80 982g x$\frac{80}{98}=\frac{2g}{x}$,解得x=2.45g。加入稀硫酸的溶质质量分数为$\frac{2.45g}{20g}×100\%=12.25\%$。
(1)3 7
(2)混合物中铜的质量分数为$\frac{3g}{10g}×100\%=30\%$。
(3)设20g稀硫酸中溶质的质量为x。CuO+H₂SO₄===CuSO₄+H₂O80 982g x$\frac{80}{98}=\frac{2g}{x}$,解得x=2.45g。加入稀硫酸的溶质质量分数为$\frac{2.45g}{20g}×100\%=12.25\%$。
29. (6分) 某科学兴趣小组根据氨气还原氧化铜的反应,设计实验测定Cu元素的相对原子质量。已知:①$2NH_{4}Cl+Ca(OH)_{2}\xlongequal{\triangle}CaCl_{2}+2NH_{3}\uparrow +2H_{2}O$;②氨气($NH_{3}$)是碱性气体。请据图回答问题:
(1) 该小组的同学利用如图所示的装置进行实验,连接装置的合理顺序是______(填序号)。
①ACBDC
②ADBCD
③ADBDC
④ABDC

(2) 将纯净干燥的氨气通入B装置中,观察到玻璃管内黑色固体变为亮红色,管口有液滴,同时生成空气中含量最多的气体。写出B装置中发生反应的化学方程式:______。
(3) 测定Cu元素相对原子质量的实验过程为:先称量$CuO$的质量为m,完全反应后测定生成水的质量为n。请计算出Cu元素的相对原子质量。(写出计算过程)
(1)(
(2)
(3)
(1) 该小组的同学利用如图所示的装置进行实验,连接装置的合理顺序是______(填序号)。
①ACBDC
②ADBCD
③ADBDC
④ABDC

(2) 将纯净干燥的氨气通入B装置中,观察到玻璃管内黑色固体变为亮红色,管口有液滴,同时生成空气中含量最多的气体。写出B装置中发生反应的化学方程式:______。
(3) 测定Cu元素相对原子质量的实验过程为:先称量$CuO$的质量为m,完全反应后测定生成水的质量为n。请计算出Cu元素的相对原子质量。(写出计算过程)
(1)(
③
)(2)
3CuO+2NH₃$\xlongequal{\triangle}$3Cu+N₂+3H₂O
(3)
设铜的相对原子质量为x。3CuO+2NH₃$\xlongequal{\triangle}$3Cu+N₂+3H₂O3x+48 54m n$\frac{3x+48}{54}=\frac{m}{n}$,解得x=$\frac{18m}{n}-16$。
答案:
(1)③
(2)3CuO+2NH₃$\xlongequal{\triangle}$3Cu+N₂+3H₂O
(3)设铜的相对原子质量为x。3CuO+2NH₃$\xlongequal{\triangle}$3Cu+N₂+3H₂O3x+48 54m n$\frac{3x+48}{54}=\frac{m}{n}$,解得x=$\frac{18m}{n}-16$。
(1)③
(2)3CuO+2NH₃$\xlongequal{\triangle}$3Cu+N₂+3H₂O
(3)设铜的相对原子质量为x。3CuO+2NH₃$\xlongequal{\triangle}$3Cu+N₂+3H₂O3x+48 54m n$\frac{3x+48}{54}=\frac{m}{n}$,解得x=$\frac{18m}{n}-16$。
30. (8分) 实验室有一包变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀)。为测定样品中$Na_{2}CO_{3}$的质量分数,小科称取10g氢氧化钠样品放入烧杯中,加入40g水使其完全溶解,将150g稀盐酸平均分成6份,依次加入烧杯中(烧杯的质量为50g),每次充分反应后都用电子天平进行称量(假设产生的气体全部逸出),实验数据如表所示,如图所示为产生气体的质量与加入稀盐酸质量的关系。
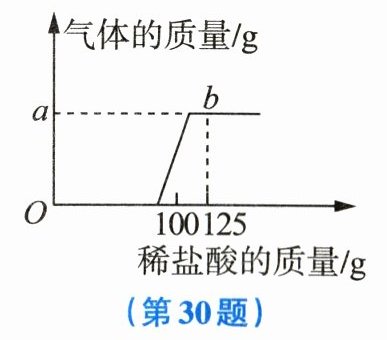
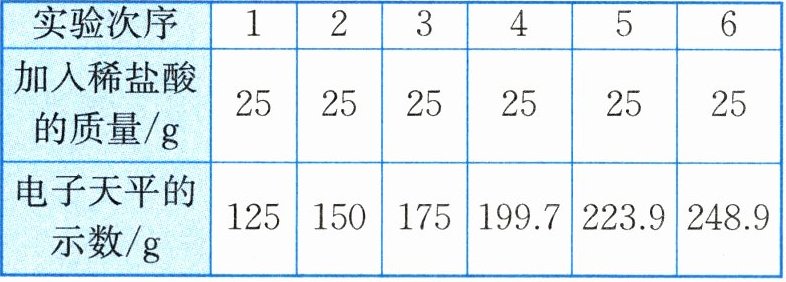
(1) 分析表格中的数据和图像,可知a的值为______。
(2) 计算氢氧化钠样品中$Na_{2}CO_{3}$的质量分数。(写出计算过程)
(3) 通过实验小科发现:氢氧化钠的变质程度不同,与酸反应的现象也不同。于是他想到:若有质量相同的两份氢氧化钠A和B,A保存完好且没有变质,B长期暴露在空气中且完全变质,向A和B中加入相同溶质质量分数的稀盐酸至恰好完全反应,需要消耗的稀盐酸的质量分别为$m_{1}和m_{2}$,则$m_{1}$______(填“大于”“等于”或“小于”)$m_{2}$。
(1)
(2)
(3)


(1) 分析表格中的数据和图像,可知a的值为______。
(2) 计算氢氧化钠样品中$Na_{2}CO_{3}$的质量分数。(写出计算过程)
(3) 通过实验小科发现:氢氧化钠的变质程度不同,与酸反应的现象也不同。于是他想到:若有质量相同的两份氢氧化钠A和B,A保存完好且没有变质,B长期暴露在空气中且完全变质,向A和B中加入相同溶质质量分数的稀盐酸至恰好完全反应,需要消耗的稀盐酸的质量分别为$m_{1}和m_{2}$,则$m_{1}$______(填“大于”“等于”或“小于”)$m_{2}$。
(1)
1.1
(2)
设氢氧化钠样品中Na₂CO₃的质量分数为x。Na₂CO₃+2HCl===2NaCl+H₂O+CO₂↑106 4410g×x 1.1g$\frac{106}{44}=\frac{10g× x}{1.1g}$,解得x=26.5%。即Na₂CO₃的质量分数为26.5%。
(3)
等于
答案:
(1)1.1
(2)设氢氧化钠样品中Na₂CO₃的质量分数为x。Na₂CO₃+2HCl===2NaCl+H₂O+CO₂↑106 4410g×x 1.1g$\frac{106}{44}=\frac{10g× x}{1.1g}$,解得x=26.5%。即Na₂CO₃的质量分数为26.5%。
(3)等于【解析】
(3)根据CO₂+2NaOH===Na₂CO₃+H₂O、Na₂CO₃+2HCl===2NaCl+H₂O+CO₂↑和NaOH+HCl===NaCl+H₂O可知,无论变质与否,参与反应的氢氧化钠与氯化氢的质量关系都是NaOH~HCl,所以无论氢氧化钠变质与否,都不影响消耗稀盐酸的质量。
(1)1.1
(2)设氢氧化钠样品中Na₂CO₃的质量分数为x。Na₂CO₃+2HCl===2NaCl+H₂O+CO₂↑106 4410g×x 1.1g$\frac{106}{44}=\frac{10g× x}{1.1g}$,解得x=26.5%。即Na₂CO₃的质量分数为26.5%。
(3)等于【解析】
(3)根据CO₂+2NaOH===Na₂CO₃+H₂O、Na₂CO₃+2HCl===2NaCl+H₂O+CO₂↑和NaOH+HCl===NaCl+H₂O可知,无论变质与否,参与反应的氢氧化钠与氯化氢的质量关系都是NaOH~HCl,所以无论氢氧化钠变质与否,都不影响消耗稀盐酸的质量。
查看更多完整答案,请扫码查看


