第32页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
26. (5分)取等质量的铁粉和锌粉,分别与足量溶质质量分数相同的稀盐酸充分反应。根据实验测定:铁粉与稀盐酸反应产生氢气的质量随加入稀盐酸质量的变化情况如图所示。请在图中画出锌粉与稀盐酸反应产生氢气的质量随加入稀盐酸的质量变化的大致曲线,并用所学的科学知识进行解释。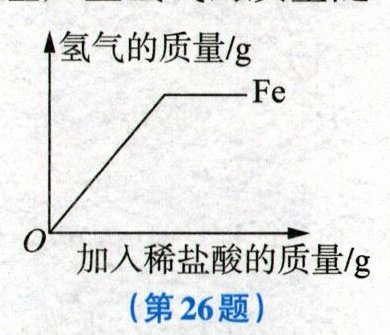

答案:
如图所示。
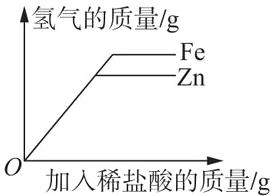
由于横坐标为加入稀盐酸的质量,在铁粉和锌粉未被消耗完时,因为加入稀盐酸的质量相等,所以生成氢气的质量相等;锌的相对原子质量大于铁,所以等质量的锌、铁与足量的稀盐酸反应时,铁生成氢气的质量较大。
如图所示。

由于横坐标为加入稀盐酸的质量,在铁粉和锌粉未被消耗完时,因为加入稀盐酸的质量相等,所以生成氢气的质量相等;锌的相对原子质量大于铁,所以等质量的锌、铁与足量的稀盐酸反应时,铁生成氢气的质量较大。
27. (5分)如图所示为某国际空间站的水气整合系统,其中“氧气生成系统”能电解水,产生氢气和氧气;“萨巴蒂尔系统”能在一定条件下使氢气和航天员呼吸产生的二氧化碳反应生成液态水和甲烷气体;液态水可即时循环利用,甲烷被排放到外太空。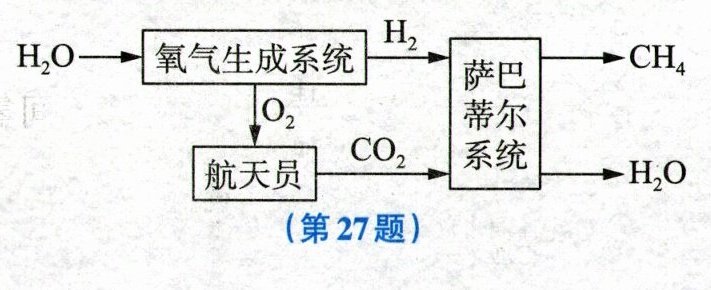
(1)图上用化学式表示的物质中,属于有机物的是
(2)已知一名航天员平均每天要消耗约0.8kg氧气,请计算一名航天员在空间站驻留30天,理论上至少需要给该水气整合系统补充多少千克的水。(已知二氧化碳足量)

(1)图上用化学式表示的物质中,属于有机物的是
甲烷
(填物质名称)。(2)已知一名航天员平均每天要消耗约0.8kg氧气,请计算一名航天员在空间站驻留30天,理论上至少需要给该水气整合系统补充多少千克的水。(已知二氧化碳足量)
答案:
(1)甲烷
(2)设生成0.8kg氧气需要水的质量为x。
2H₂O$\xlongequal{通电}$2H₂↑+O₂↑
36 32
x 0.8kg
$\frac{36}{x}$=$\frac{32}{0.8kg}$,解得x=0.9kg。
氢气和二氧化碳反应的化学方程式为CO₂+4H₂$\xlongequal{一定条件}$2H₂O+CH₄,结合两个反应的化学方程式可知,水气整合系统电解的水有一半可以循环利用,因此理论上至少需要给该水气整合系统补充水的质量为0.9kg×0.5×30=13.5kg。
(1)甲烷
(2)设生成0.8kg氧气需要水的质量为x。
2H₂O$\xlongequal{通电}$2H₂↑+O₂↑
36 32
x 0.8kg
$\frac{36}{x}$=$\frac{32}{0.8kg}$,解得x=0.9kg。
氢气和二氧化碳反应的化学方程式为CO₂+4H₂$\xlongequal{一定条件}$2H₂O+CH₄,结合两个反应的化学方程式可知,水气整合系统电解的水有一半可以循环利用,因此理论上至少需要给该水气整合系统补充水的质量为0.9kg×0.5×30=13.5kg。
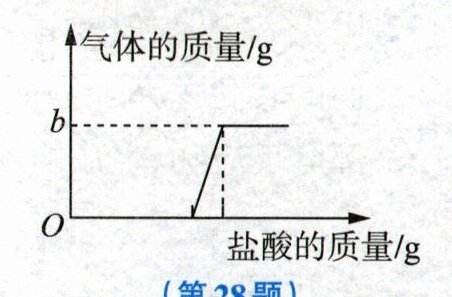
28. (8分)小宁在化学实验室发现了一瓶敞口放置的$Ca(OH)_2$粉末状试剂。他对该试剂进行了定量实验分析:称取19.8g试剂放入锥形瓶中,加入30.2g水,充分振荡,再向锥形瓶中依次滴加25g盐酸,充分反应后,测得部分数据如表所示,并绘制了相关图像。

(1)a的值为
(2)小宁通过实验,得出该试剂已
(3)b的值为
(4)该试剂中氢氧化钙的质量分数是多少?(写出计算过程,结果精确到0.1%)

(1)a的值为
125
。(2)小宁通过实验,得出该试剂已
部分
(填“部分”或“全部”)变质的结论。(3)b的值为
2.2
。(4)该试剂中氢氧化钙的质量分数是多少?(写出计算过程,结果精确到0.1%)

设试剂中碳酸钙的质量为x。
CaCO₃+2HCl$\xlongequal{}$CaCl₂+H₂O+CO₂↑
100 44
x 2.2g
$\frac{100}{x}$=$\frac{44}{2.2g}$,解得x=5g。
故试剂中氢氧化钙的质量分数为$\frac{19.8g−5g}{19.8g}$×100%≈74.7%。
CaCO₃+2HCl$\xlongequal{}$CaCl₂+H₂O+CO₂↑
100 44
x 2.2g
$\frac{100}{x}$=$\frac{44}{2.2g}$,解得x=5g。
故试剂中氢氧化钙的质量分数为$\frac{19.8g−5g}{19.8g}$×100%≈74.7%。
答案:
(1)125
(2)部分
(3)2.2
(4)设试剂中碳酸钙的质量为x。
CaCO₃+2HCl$\xlongequal{}$CaCl₂+H₂O+CO₂↑
100 44
x 2.2g
$\frac{100}{x}$=$\frac{44}{2.2g}$,解得x=5g。
故试剂中氢氧化钙的质量分数为$\frac{19.8g−5g}{19.8g}$×100%≈74.7%。
[解析]
(1)由表中的数据可知,第1、2、4次加入盐酸的质量就等于锥形瓶中增加的质量,所以第3次加入盐酸后物质的质量就是前2次锥形瓶中物质的质量再加上盐酸的质量,故a的值为100+25=125。
(2)由实验数据和图像可知,第5次滴加盐酸时,开始有二氧化碳生成,证明有碳酸钙存在。而此前滴加盐酸时无现象,说明盐酸与氢氧化钙反应,从而证明氢氧化钙存在。据此得出该试剂已部分变质的结论。
(3)由表中的数据可知,第6次加入盐酸的质量就等于锥形瓶增加的质量,说明第5次加入的盐酸已将碳酸钙完全反应,则生成二氧化碳的质量为150g+25g−172.8g=2.2g。
(1)125
(2)部分
(3)2.2
(4)设试剂中碳酸钙的质量为x。
CaCO₃+2HCl$\xlongequal{}$CaCl₂+H₂O+CO₂↑
100 44
x 2.2g
$\frac{100}{x}$=$\frac{44}{2.2g}$,解得x=5g。
故试剂中氢氧化钙的质量分数为$\frac{19.8g−5g}{19.8g}$×100%≈74.7%。
[解析]
(1)由表中的数据可知,第1、2、4次加入盐酸的质量就等于锥形瓶中增加的质量,所以第3次加入盐酸后物质的质量就是前2次锥形瓶中物质的质量再加上盐酸的质量,故a的值为100+25=125。
(2)由实验数据和图像可知,第5次滴加盐酸时,开始有二氧化碳生成,证明有碳酸钙存在。而此前滴加盐酸时无现象,说明盐酸与氢氧化钙反应,从而证明氢氧化钙存在。据此得出该试剂已部分变质的结论。
(3)由表中的数据可知,第6次加入盐酸的质量就等于锥形瓶增加的质量,说明第5次加入的盐酸已将碳酸钙完全反应,则生成二氧化碳的质量为150g+25g−172.8g=2.2g。
29. (6分)科学家尝试通过多种途径减少$CO_2$的排放,或将$CO_2$转化为有用的物质。其中一种途径是利用NaOH溶液来“捕捉$”CO_2,$并将$CO_2$进行储存或利用,反应流程如图所示。
(1)反应分离室中分离物质的操作是
(2)上述反应流程中,可循环利用的物质是
(3)若反应分离室中有溶质质量分数为10.6%的$Na_2CO_3$溶液100kg,求完全反应后,理论上可生成$CaCO_3$的质量。(要求根据化学方程式计算)
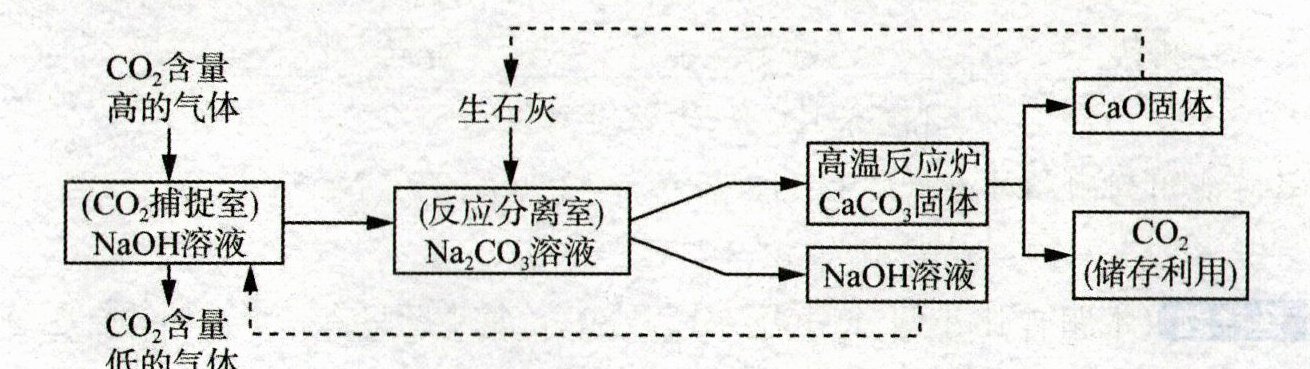
(1)反应分离室中分离物质的操作是
过滤
。(2)上述反应流程中,可循环利用的物质是
NaOH和CaO
。(3)若反应分离室中有溶质质量分数为10.6%的$Na_2CO_3$溶液100kg,求完全反应后,理论上可生成$CaCO_3$的质量。(要求根据化学方程式计算)

设理论上生成碳酸钙的质量为x。
Ca(OH)₂+Na₂CO₃$\xlongequal{}$CaCO₃↓+2NaOH
106 100
100kg×10.6% x
$\frac{106}{100}$=$\frac{100kg×10.6\%}{x}$,解得x=10kg。
Ca(OH)₂+Na₂CO₃$\xlongequal{}$CaCO₃↓+2NaOH
106 100
100kg×10.6% x
$\frac{106}{100}$=$\frac{100kg×10.6\%}{x}$,解得x=10kg。
答案:
(1)过滤
(2)NaOH和CaO
(3)设理论上生成碳酸钙的质量为x。
Ca(OH)₂+Na₂CO₃$\xlongequal{}$CaCO₃↓+2NaOH
106 100
100kg×10.6% x
$\frac{106}{100}$=$\frac{100kg×10.6\%}{x}$,解得x=10kg。
(1)过滤
(2)NaOH和CaO
(3)设理论上生成碳酸钙的质量为x。
Ca(OH)₂+Na₂CO₃$\xlongequal{}$CaCO₃↓+2NaOH
106 100
100kg×10.6% x
$\frac{106}{100}$=$\frac{100kg×10.6\%}{x}$,解得x=10kg。
30. (8分)小科用如图所示的装置来探究炼铁的反应原理,称取10g赤铁矿样品(主要成分为Fe₂O₃,杂质不含Fe元素且不与酸反应),在硬质玻璃管中铺开,充分加热至样品完全反应(化学方程式为Fe₂O₃+3CO $\xlongequal{高温}$ 2Fe+3CO₂),熄灭酒精喷灯,继续通入CO至硬质玻璃管冷却,将反应后的固体进行酸洗(除去反应生成的Fe)并干燥,称量出剩余固体杂质的质量为2g。
(1)已知一氧化碳发生装置内得到的CO气体中混有杂质CO₂和H₂O,则装置A的作用是
(2)从环保角度考虑,请写出一种处理尾气的方法:
(3)请计算样品中铁元素的质量。(写出计算过程)
由于剩余固体杂质的质量为2g,所以10g赤铁矿粉末中氧化铁的质量为10g−2g=8g。
设样品中铁元素的质量为x。
3CO+Fe₂O₃$\xlongequal{高温}$2Fe+3CO₂
160 112
8g x
$\frac{160}{112}$=$\frac{8g}{x}$,解得x=5.6g。
即样品中铁元素的质量为5.6g。
(1)已知一氧化碳发生装置内得到的CO气体中混有杂质CO₂和H₂O,则装置A的作用是
除去CO中混有的杂质CO₂和H₂O
。(2)从环保角度考虑,请写出一种处理尾气的方法:
点燃尾气
。(3)请计算样品中铁元素的质量。(写出计算过程)
由于剩余固体杂质的质量为2g,所以10g赤铁矿粉末中氧化铁的质量为10g−2g=8g。
设样品中铁元素的质量为x。
3CO+Fe₂O₃$\xlongequal{高温}$2Fe+3CO₂
160 112
8g x
$\frac{160}{112}$=$\frac{8g}{x}$,解得x=5.6g。
即样品中铁元素的质量为5.6g。
答案:
(1)除去CO中混有的杂质CO₂和H₂O
(2)点燃尾气
(3)由于剩余固体杂质的质量为2g,所以10g赤铁矿粉末中氧化铁的质量为10g−2g=8g。
设样品中铁元素的质量为x。
3CO+Fe₂O₃$\xlongequal{高温}$2Fe+3CO₂
160 112
8g x
$\frac{160}{112}$=$\frac{8g}{x}$,解得x=5.6g。
即样品中铁元素的质量为5.6g。
(1)除去CO中混有的杂质CO₂和H₂O
(2)点燃尾气
(3)由于剩余固体杂质的质量为2g,所以10g赤铁矿粉末中氧化铁的质量为10g−2g=8g。
设样品中铁元素的质量为x。
3CO+Fe₂O₃$\xlongequal{高温}$2Fe+3CO₂
160 112
8g x
$\frac{160}{112}$=$\frac{8g}{x}$,解得x=5.6g。
即样品中铁元素的质量为5.6g。
查看更多完整答案,请扫码查看


