第4页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
27. (6分)学习科学的重要方法之一是对知识点的归纳和总结,学习酸的性质后,小敏总结了酸的化学性质,如图所示。请根据要求回答下列问题:
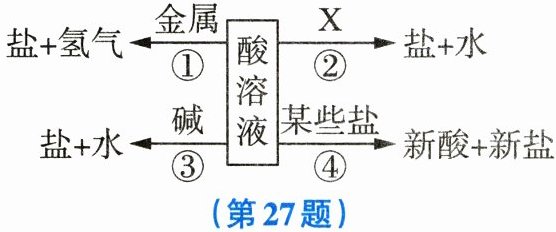
(1)酸溶液有相似化学性质的原因是溶液中都含有
(2)若图中的X代表一类物质,则X为
(3)性质③对应的反应的实质是

(1)酸溶液有相似化学性质的原因是溶液中都含有
H⁺
(填离子符号)。(2)若图中的X代表一类物质,则X为
金属氧化物
(填物质类别)。(3)性质③对应的反应的实质是
氢离子和氢氧根离子结合生成水分子
。
答案:
(1)H⁺
(2)金属氧化物
(3)氢离子和氢氧根离子结合生成水分子
(1)H⁺
(2)金属氧化物
(3)氢离子和氢氧根离子结合生成水分子
28. (8分)调味剂的主要作用是补充或增强食品的味道。食醋是一种能增强食品酸味的调味剂,主要成分为醋酸$(CH_3COOH),$与我们的生活密切相连。请根据所学知识回答下列问题:
(1)食醋能作酸味的调味剂,是因为醋酸在水溶液中能解离出$CH_3COO⁻$和
(2)食醋的酸味能促进人胃酸的分泌,胃酸的主要成分是
(3)醋酸中碳元素的质量分数为
(4)生活中常用酒来制取食醋,原理是酒中的$CH_3CH_2OH$在酶的作用下与空气中的$O_2$反应得到醋酸和另一种液体。已知在用酒制取食醋的过程中,质量增加了16kg,则所得食醋中醋酸的质量为
(1)食醋能作酸味的调味剂,是因为醋酸在水溶液中能解离出$CH_3COO⁻$和
H⁺
(填离子符号)。(2)食醋的酸味能促进人胃酸的分泌,胃酸的主要成分是
HCl
(填化学式)。(3)醋酸中碳元素的质量分数为
40%
。(4)生活中常用酒来制取食醋,原理是酒中的$CH_3CH_2OH$在酶的作用下与空气中的$O_2$反应得到醋酸和另一种液体。已知在用酒制取食醋的过程中,质量增加了16kg,则所得食醋中醋酸的质量为
30
kg。
答案:
(1)H⁺
(2)HCl
(3)40%
(4)30
(1)H⁺
(2)HCl
(3)40%
(4)30
29. (6分)向一定质量的含杂质的锌样品中加入稀硫酸,使其充分反应(杂质不与稀硫酸反应),所加稀硫酸与生成气体的质量关系如图所示。(提示:稀硫酸与锌反应生成硫酸锌和氢气)
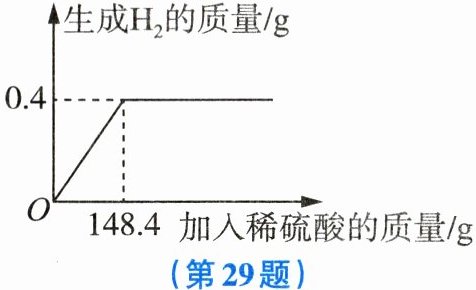
(1)锌样品与稀硫酸充分反应后生成氢气的总质量为
(2)求样品中锌的质量(请写出具体的计算过程)。

(1)锌样品与稀硫酸充分反应后生成氢气的总质量为
0.4
g。(2)求样品中锌的质量(请写出具体的计算过程)。
答案:
(1)0.4
(2)设样品中锌的质量为x。 Zn+H₂SO₄=ZnSO₄+H₂↑ 65 2 x 0.4g 65/2=x/0.4g,解得x=13g。 即样品中锌的质量为13g。
(1)0.4
(2)设样品中锌的质量为x。 Zn+H₂SO₄=ZnSO₄+H₂↑ 65 2 x 0.4g 65/2=x/0.4g,解得x=13g。 即样品中锌的质量为13g。
30. (8分)某校科学兴趣小组的同学为了测定某石灰石中碳酸钙的质量分数,取该石灰石样品10g加入烧杯中,再将80g稀盐酸分四次加入烧杯中,实验过程所得数据如下表所示(已知石灰石样品中含有的杂质既不溶于水,也不与稀盐酸反应):
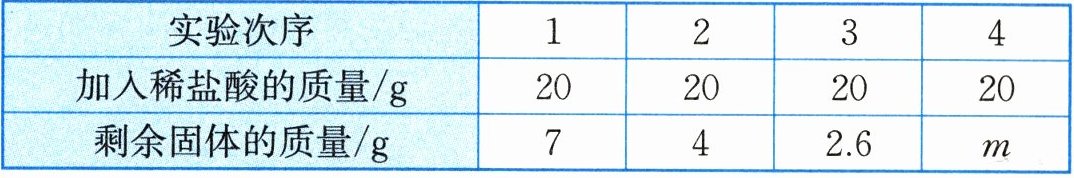
分析表中数据,回答下列问题:
(1)表中m的数值为
(2)该石灰石样品中碳酸钙的质量分数为
(3)计算第1次实验反应结束后所得溶液中溶质的质量分数。(计算结果精确到0.1%)

分析表中数据,回答下列问题:
(1)表中m的数值为
2.6
。(2)该石灰石样品中碳酸钙的质量分数为
74%
。(3)计算第1次实验反应结束后所得溶液中溶质的质量分数。(计算结果精确到0.1%)
设第1次反应生成氯化钙的质量为x,生成二氧化碳的质量为y。 CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑ 100 111 44 3g x y 100/111=3g/x,100/44=3g/y,解得x=3.33g,y=1.32g。 所以第1次实验反应结束后所得溶液中溶质的质量分数为3.33g/(20g+10g-7g-1.32g)×100%≈15.4%。
答案:
(1)2.6
(2)74%
(3)设第1次反应生成氯化钙的质量为x,生成二氧化碳的质量为y。 CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑ 100 111 44 3g x y 100/111=3g/x,100/44=3g/y,解得x=3.33g,y=1.32g。 所以第1次实验反应结束后所得溶液中溶质的质量分数为3.33g/(20g+10g-7g-1.32g)×100%≈15.4%。
(1)2.6
(2)74%
(3)设第1次反应生成氯化钙的质量为x,生成二氧化碳的质量为y。 CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑ 100 111 44 3g x y 100/111=3g/x,100/44=3g/y,解得x=3.33g,y=1.32g。 所以第1次实验反应结束后所得溶液中溶质的质量分数为3.33g/(20g+10g-7g-1.32g)×100%≈15.4%。
查看更多完整答案,请扫码查看


