第3页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
22. 如图所示为某饮料标签上的部分内容。

(1)该饮料的pH
(2)如何检验一种无色溶液是否呈酸性?请设计两种实验方案。①

(1)该饮料的pH
<
(填“>”“<”或“=”)7。(2)如何检验一种无色溶液是否呈酸性?请设计两种实验方案。①
取少量该无色溶液置于试管中,向其中滴加紫色石蕊试液,若紫色石蕊试液变成红色,则证明该无色溶液具有酸性
;②取少量该无色溶液置于试管中,向其中滴加碳酸钠溶液,若有气泡产生,则证明该无色溶液呈酸性
(写出简要的实验步骤、现象及结论)。
答案:
(1)<
(2)①取少量该无色溶液置于试管中,向其中滴加紫色石蕊试液,若紫色石蕊试液变成红色,则证明该无色溶液具有酸性 ②取少量该无色溶液置于试管中,向其中滴加碳酸钠溶液,若有气泡产生,则证明该无色溶液呈酸性
(1)<
(2)①取少量该无色溶液置于试管中,向其中滴加紫色石蕊试液,若紫色石蕊试液变成红色,则证明该无色溶液具有酸性 ②取少量该无色溶液置于试管中,向其中滴加碳酸钠溶液,若有气泡产生,则证明该无色溶液呈酸性
23. 某同学要在一块空地上种植作物,于是对这块空地的土壤酸碱度进行测定。
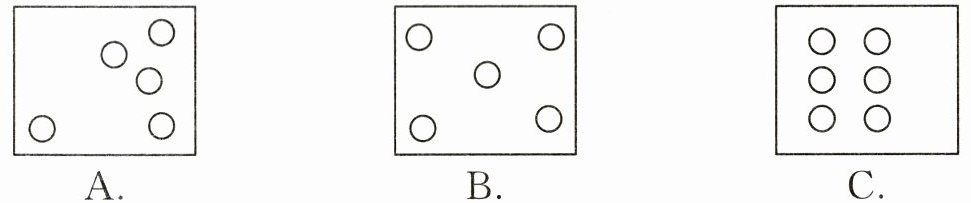
(1)在空地上选取5~6个位置,进行取样,测定土壤酸碱度。下列三种取样位置中,设定相对合理的是(
(2)将采集到的土样进行处理后,测定土壤pH的方法是
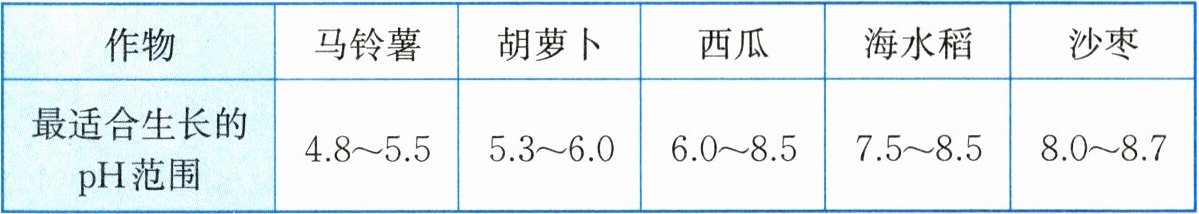
(3)根据颜色对比,空地上土壤的pH约为7.8,通过查阅资料发现,常见作物最适合生长的土壤pH范围如表所示,则这块空地上适合种植的作物有
(1)在空地上选取5~6个位置,进行取样,测定土壤酸碱度。下列三种取样位置中,设定相对合理的是(
B
)。
(2)将采集到的土样进行处理后,测定土壤pH的方法是
在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取土壤浸出液,滴到pH试纸上,把试纸显示的颜色与标准比色卡进行比较,看与哪种颜色最接近,读出pH
。(3)根据颜色对比,空地上土壤的pH约为7.8,通过查阅资料发现,常见作物最适合生长的土壤pH范围如表所示,则这块空地上适合种植的作物有
西瓜、海水稻
。
答案:
(1)B
(2)在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取土壤浸出液,滴到pH试纸上,把试纸显示的颜色与标准比色卡进行比较,看与哪种颜色最接近,读出pH
(3)西瓜、海水稻
(1)B
(2)在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取土壤浸出液,滴到pH试纸上,把试纸显示的颜色与标准比色卡进行比较,看与哪种颜色最接近,读出pH
(3)西瓜、海水稻
24. 为加深对酸的主要性质的认识,老师组织同学们完成了以下实验活动。
【实验内容与分析】
实验一:按右图完成实验。
实验二:往生锈的铁钉中加入足量的稀盐酸。
实验三:往滴有酚酞试液的氢氧化钠溶液中加入一定量的稀盐酸。
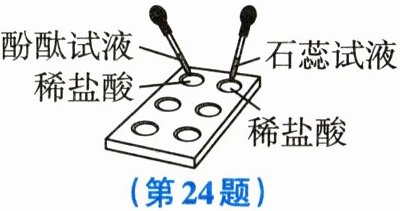
(1)实验一中,观察到石蕊试液变成
(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因:
(3)实验三中,观察到溶液由红色变成无色,由此现象分析可知,反应后所得的溶液中,溶质成分的可能组合有(不考虑酚酞试液)
【实验内容与分析】
实验一:按右图完成实验。
实验二:往生锈的铁钉中加入足量的稀盐酸。
实验三:往滴有酚酞试液的氢氧化钠溶液中加入一定量的稀盐酸。

(1)实验一中,观察到石蕊试液变成
红
色。(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因:
溶液由无色变成黄色,是因为氧化铁和稀盐酸反应生成氯化铁和水,氯化铁溶液呈黄色;一段时间后有气泡产生,是因为铁和稀盐酸反应生成氯化亚铁和氢气
。(3)实验三中,观察到溶液由红色变成无色,由此现象分析可知,反应后所得的溶液中,溶质成分的可能组合有(不考虑酚酞试液)
NaCl;NaCl、HCl
(用化学式表示)。
答案:
(1)红
(2)溶液由无色变成黄色,是因为氧化铁和稀盐酸反应生成氯化铁和水,氯化铁溶液呈黄色;一段时间后有气泡产生,是因为铁和稀盐酸反应生成氯化亚铁和氢气
(3)NaCl;NaCl、HCl
(1)红
(2)溶液由无色变成黄色,是因为氧化铁和稀盐酸反应生成氯化铁和水,氯化铁溶液呈黄色;一段时间后有气泡产生,是因为铁和稀盐酸反应生成氯化亚铁和氢气
(3)NaCl;NaCl、HCl
25. 某班同学为验证酸的通性,做了如图所示的五组实验。请分析并回答下列问题:
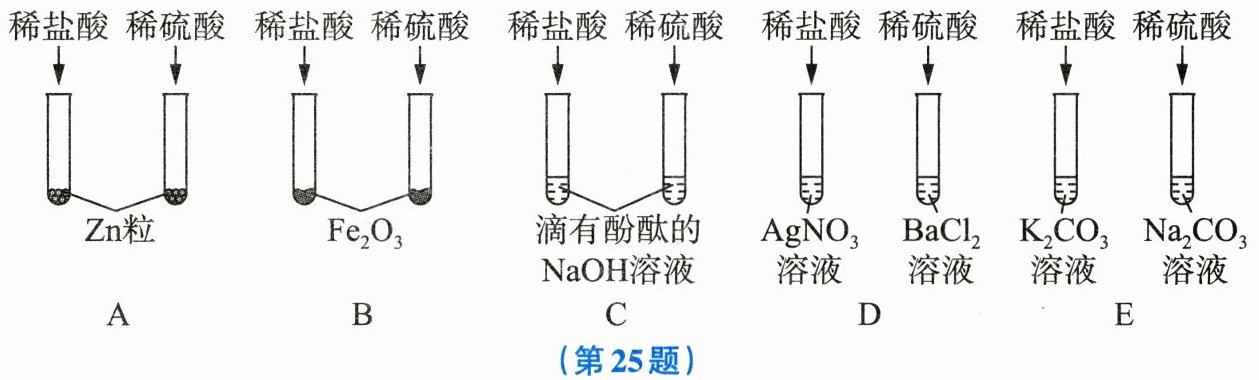
(1)A组试管中都会产生$H_2,$若要制得较纯的$H_2,$则应选用稀硫酸,不选用盐酸的原因是
(2)B组试管中实验现象相同,该现象是
(3)写出C组任一试管中发生反应的化学方程式:
(4)上述五组实验中,没有体现酸的通性的是

(1)A组试管中都会产生$H_2,$若要制得较纯的$H_2,$则应选用稀硫酸,不选用盐酸的原因是
盐酸具有挥发性,会挥发出氯化氢气体,使制得的氢气中混有氯化氢气体
。(2)B组试管中实验现象相同,该现象是
红棕色固体逐渐减少,溶液变成黄色
。(3)写出C组任一试管中发生反应的化学方程式:
NaOH+HCl=NaCl+H₂O(或2NaOH+H₂SO₄=Na₂SO₄+2H₂O)
。(4)上述五组实验中,没有体现酸的通性的是
D
(填字母)。
答案:
(1)盐酸具有挥发性,会挥发出氯化氢气体,使制得的氢气中混有氯化氢气体
(2)红棕色固体逐渐减少,溶液变成黄色
(3)NaOH+HCl=NaCl+H₂O(或2NaOH+H₂SO₄=Na₂SO₄+2H₂O)
(4)D
(1)盐酸具有挥发性,会挥发出氯化氢气体,使制得的氢气中混有氯化氢气体
(2)红棕色固体逐渐减少,溶液变成黄色
(3)NaOH+HCl=NaCl+H₂O(或2NaOH+H₂SO₄=Na₂SO₄+2H₂O)
(4)D
26. (4分)如图所示,将充满气体$NO_2$的试管倒插入足量的滴有紫色石蕊试液的蒸馏水中,请根据以下信息及所学知识判断实验现象,并分析其产生的原因。(反应引起的温度变化忽略不计)
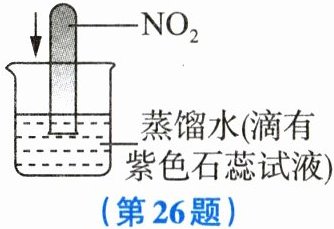
资料Ⅰ:$NO_2$和水会发生反应,化学方程式为$3NO_2+H_2O=NO+2HNO_3。$
资料Ⅱ:$NO_2$为有刺激性气味的红棕色气体,NO是一种无色无味、难溶于水的气体。
资料Ⅲ:同温同压下,两种气体的体积之比等于这两种气体的分子个数之比。

资料Ⅰ:$NO_2$和水会发生反应,化学方程式为$3NO_2+H_2O=NO+2HNO_3。$
资料Ⅱ:$NO_2$为有刺激性气味的红棕色气体,NO是一种无色无味、难溶于水的气体。
资料Ⅲ:同温同压下,两种气体的体积之比等于这两种气体的分子个数之比。
答案:
现象:红棕色气体消失,试管中的液面上升至距试管口三分之二处,溶液变为红色。原因:二氧化氮和水反应,每3体积的二氧化氮完全反应生成1体积的一氧化氮,一氧化氮为无色气体;同时该反应生成硝酸,硝酸显酸性,能使石蕊试液变成红色。
查看更多完整答案,请扫码查看


