第79页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
5. 有关$K_{sp}$的判断
|实验操作及现象|实验结论|判断(填“√”或“×”)|
| ---- | ---- | ---- |
|(1)将$0.1\ mol\cdot L^{-1}\ MgSO_{4}$溶液滴入$NaOH$溶液中至不再有沉淀产生,再滴加$0.1\ mol\cdot L^{-1}\ CuSO_{4}$溶液,先有白色沉淀生成,后变为浅蓝色沉淀|$K_{sp}[Cu(OH)_{2}] < K_{sp}[Mg(OH)_{2}]$| |
|(2)向$10\ mL\ 0.2\ mol\cdot L^{-1}\ NaOH$溶液中滴入$2$滴$0.1\ mol\cdot L^{-1}\ MgCl_{2}$溶液,有白色沉淀生成,再滴加$2$滴$0.1\ mol\cdot L^{-1}\ FeCl_{3}$溶液,有红褐色沉淀生成|$K_{sp}[Mg(OH)_{2}] > K_{sp}[Fe(OH)_{3}]$| |
|(3)向$2\ mL\ 0.01\ mol\cdot L^{-1}\ Na_{2}S$溶液中先滴入几滴$0.01\ mol\cdot L^{-1}\ ZnSO_{4}$溶液,有白色沉淀生成,再滴入几滴$0.01\ mol\cdot L^{-1}\ CuSO_{4}$溶液,有黑色沉淀生成|$K_{sp}(CuS) < K_{sp}(ZnS)$| |


特别提醒 ①要看清楚沉淀是直接生成的,还是由其他沉淀转化而来的,若是直接生成的,则无法比较$K_{sp}$的大小。②生成沉淀的颜色要不同,否则无法比较$K_{sp}$的大小。③若往沉淀中加入浓溶液或饱和溶液,则无法比较$K_{sp}$的大小。
|实验操作及现象|实验结论|判断(填“√”或“×”)|
| ---- | ---- | ---- |
|(1)将$0.1\ mol\cdot L^{-1}\ MgSO_{4}$溶液滴入$NaOH$溶液中至不再有沉淀产生,再滴加$0.1\ mol\cdot L^{-1}\ CuSO_{4}$溶液,先有白色沉淀生成,后变为浅蓝色沉淀|$K_{sp}[Cu(OH)_{2}] < K_{sp}[Mg(OH)_{2}]$| |
|(2)向$10\ mL\ 0.2\ mol\cdot L^{-1}\ NaOH$溶液中滴入$2$滴$0.1\ mol\cdot L^{-1}\ MgCl_{2}$溶液,有白色沉淀生成,再滴加$2$滴$0.1\ mol\cdot L^{-1}\ FeCl_{3}$溶液,有红褐色沉淀生成|$K_{sp}[Mg(OH)_{2}] > K_{sp}[Fe(OH)_{3}]$| |
|(3)向$2\ mL\ 0.01\ mol\cdot L^{-1}\ Na_{2}S$溶液中先滴入几滴$0.01\ mol\cdot L^{-1}\ ZnSO_{4}$溶液,有白色沉淀生成,再滴入几滴$0.01\ mol\cdot L^{-1}\ CuSO_{4}$溶液,有黑色沉淀生成|$K_{sp}(CuS) < K_{sp}(ZnS)$| |


特别提醒 ①要看清楚沉淀是直接生成的,还是由其他沉淀转化而来的,若是直接生成的,则无法比较$K_{sp}$的大小。②生成沉淀的颜色要不同,否则无法比较$K_{sp}$的大小。③若往沉淀中加入浓溶液或饱和溶液,则无法比较$K_{sp}$的大小。
答案:
(1)√
(2)×
(3)×
(1)√
(2)×
(3)×
1.(2024·河北,6)下列实验操作及现象能得出相应结论的是( )
|选项|实验操作及现象|结论|
| ---- | ---- | ---- |
|A|还原铁粉与水蒸气反应生成的气体点燃后有爆鸣声|$H_{2}O$具有还原性|
|B|待测液中滴加$BaCl_{2}$溶液,生成白色沉淀|待测液含有$SO_{4}^{2 - }$|
|C|$Mg(OH)_{2}$和$Al(OH)_{3}$中均分别加入$NaOH$溶液和盐酸,$Mg(OH)_{2}$只溶于盐酸,$Al(OH)_{3}$都能溶|$Mg(OH)_{2}$比$Al(OH)_{3}$碱性强|
|D|$K_{2}Cr_{2}O_{7}$溶液中滴加$NaOH$溶液,溶液由橙色变为黄色|增大生成物的浓度,平衡向逆反应方向移动|

|选项|实验操作及现象|结论|
| ---- | ---- | ---- |
|A|还原铁粉与水蒸气反应生成的气体点燃后有爆鸣声|$H_{2}O$具有还原性|
|B|待测液中滴加$BaCl_{2}$溶液,生成白色沉淀|待测液含有$SO_{4}^{2 - }$|
|C|$Mg(OH)_{2}$和$Al(OH)_{3}$中均分别加入$NaOH$溶液和盐酸,$Mg(OH)_{2}$只溶于盐酸,$Al(OH)_{3}$都能溶|$Mg(OH)_{2}$比$Al(OH)_{3}$碱性强|
|D|$K_{2}Cr_{2}O_{7}$溶液中滴加$NaOH$溶液,溶液由橙色变为黄色|增大生成物的浓度,平衡向逆反应方向移动|

答案:
C [铁与水蒸气反应生成的气体是 H₂,H 由 +1 价降低至 0 价,H₂O 表现出氧化性,A 错误;若待测液中含有 Ag⁺,Ag⁺与 Cl⁻反应也能产生白色沉淀,若待测液中含有 CO₃²⁻、SO₃²⁻,二者都能与 Ba²⁺反应产生白色沉淀,通过该实验不能得出待测液中含有 SO₄²⁻的结论,B 错误;Mg(OH)₂溶液能与盐酸反应,不能与 NaOH 溶液反应,Al(OH)₃与 NaOH 溶液和盐酸都能反应,说明 Mg(OH)₂的碱性比 Al(OH)₃的强,C 正确;K₂Cr₂O₇溶液中存在平衡:Cr₂O₇²⁻(橙色)+H₂O⇌2CrO₄²⁻(黄色)+2H⁺,加入 NaOH 溶液后,OH⁻与 H⁺反应,c(H⁺)减小,使平衡正向移动,溶液由橙色变为黄色,D 错误。]
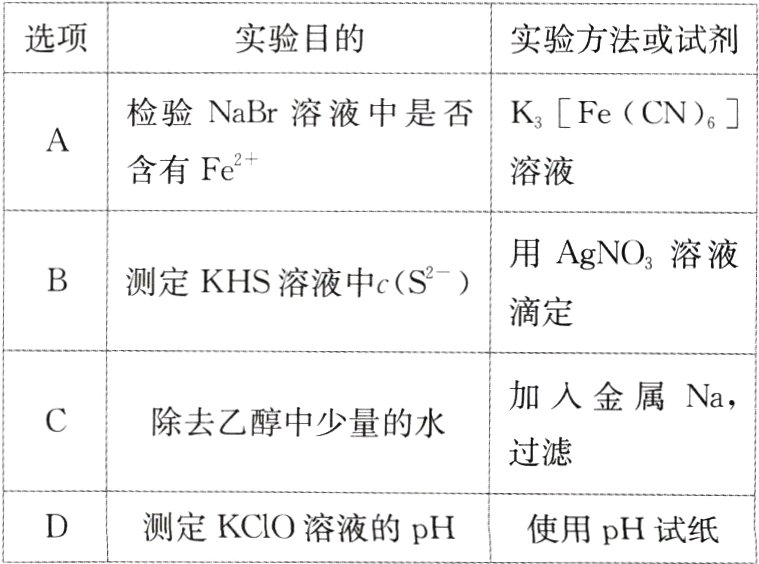
2.(2024·黑吉辽,8)下列实验方法或试剂使用合理的是( )
|选项|实验目的|实验方法或试剂|
| ---- | ---- | ---- |
|A|检验$NaBr$溶液中是否含有$Fe^{2 + }$|$K_{3}[Fe(CN)_{6}]$溶液|
|B|测定$KHS$溶液中$c(S^{2 - })$|用$AgNO_{3}$溶液滴定|
|C|除去乙醇中少量的水|加入金属$Na$,过滤|
|D|测定$KClO$溶液的$pH$|使用$pH$试纸|
|选项|实验目的|实验方法或试剂|
| ---- | ---- | ---- |
|A|检验$NaBr$溶液中是否含有$Fe^{2 + }$|$K_{3}[Fe(CN)_{6}]$溶液|
|B|测定$KHS$溶液中$c(S^{2 - })$|用$AgNO_{3}$溶液滴定|
|C|除去乙醇中少量的水|加入金属$Na$,过滤|
|D|测定$KClO$溶液的$pH$|使用$pH$试纸|

答案:
A [Fe²⁺与 K₃[Fe(CN)₆]溶液发生反应生成蓝色沉淀,A 项合理;金属 Na 既可以和水发生反应又可以和乙醇发生反应,故不能用金属 Na 除去乙醇中少量的水,C 项不合理;ClO⁻具有氧化性,不能用 pH 试纸测定其 pH,可以用 pH 计进行测量,D 项不合理。]
查看更多完整答案,请扫码查看


