第3页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
1.(2024·新课标卷,10)对于下列过程中发生的化学反应,相应离子方程式正确的是 ( )
A. 试管壁上的银镜用稀硝酸清洗:$Ag + 2H^{+} + NO_{3}^{-} = Ag^{+} + NO_{2}\uparrow + H_{2}O$
B. 工业废水中的$Pb^{2 + }$用$FeS$去除:$Pb^{2 + } + S^{2 - } = PbS\downarrow$
C. 海水提溴过程中将溴吹入$SO_{2}$吸收塔:$Br_{2} + SO_{2} + 2H_{2}O = 2Br^{-} + SO_{4}^{2 - } + 4H^{+}$
D. 用草酸标准溶液测定高锰酸钾溶液的浓度:$2MnO_{4}^{-} + 5C_{2}O_{4}^{2 - } + 16H^{+} = 2Mn^{2 + } + 10CO_{2}\uparrow + 8H_{2}O$
A. 试管壁上的银镜用稀硝酸清洗:$Ag + 2H^{+} + NO_{3}^{-} = Ag^{+} + NO_{2}\uparrow + H_{2}O$
B. 工业废水中的$Pb^{2 + }$用$FeS$去除:$Pb^{2 + } + S^{2 - } = PbS\downarrow$
C. 海水提溴过程中将溴吹入$SO_{2}$吸收塔:$Br_{2} + SO_{2} + 2H_{2}O = 2Br^{-} + SO_{4}^{2 - } + 4H^{+}$
D. 用草酸标准溶液测定高锰酸钾溶液的浓度:$2MnO_{4}^{-} + 5C_{2}O_{4}^{2 - } + 16H^{+} = 2Mn^{2 + } + 10CO_{2}\uparrow + 8H_{2}O$
答案:
C [银与稀硝酸反应生成硝酸银、一氧化氮和水,该反应的离子方程式为$3Ag + 4H^{+}+NO_{3}^{-}=3Ag^{+}+NO\uparrow +2H_{2}O$,A错误;$FeS$为难溶物,在离子方程式中不拆分,反应的离子方程式为$Pb^{2+}+FeS = PbS + Fe^{2+}$,B错误;$SO_{2}$具有还原性,海水提溴过程中将溴吹入$SO_{2}$吸收塔时,$Br_{2}$被还原为$Br^{-}$,该反应的离子方程式为$Br_{2}+SO_{2}+2H_{2}O = 2Br^{-}+SO_{4}^{2 - }+4H^{+}$,C正确;$H_{2}C_{2}O_{4}$属于弱酸,在书写离子方程式时不能拆分,反应的离子方程式为$2MnO_{4}^{-}+5H_{2}C_{2}O_{4}+6H^{+}=2Mn^{2+}+10CO_{2}\uparrow +8H_{2}O$,D错误。]
2.(2024·湖南,6)下列过程中,对应的反应方程式错误的是 ( )
|选项|描述|反应方程式|
| ---- | ---- | ---- |
|A|《天工开物》记载用炉甘石($ZnCO_{3}$)火法炼锌|$2ZnCO_{3} + C \stackrel{高温}{=\!=\!=} 2Zn + 3CO\uparrow$|
|B|$CaH_{2}$用作野外生氢剂|$CaH_{2} + 2H_{2}O = Ca(OH)_{2} + 2H_{2}\uparrow$|
|C|饱和$Na_{2}CO_{3}$溶液浸泡锅炉水垢|$CaSO_{4}(s) + CO_{3}^{2 - }(aq) \rightleftharpoons CaCO_{3}(s) + SO_{4}^{2 - }(aq)$|
|D|绿矾($FeSO_{4}·7H_{2}O$)处理酸性工业废水中的$Cr_{2}O_{7}^{2 - }$|$6Fe^{2 + } + Cr_{2}O_{7}^{2 - } + 14H^{+} = 6Fe^{3 + } + 2Cr^{3 + } + 7H_{2}O$|


|选项|描述|反应方程式|
| ---- | ---- | ---- |
|A|《天工开物》记载用炉甘石($ZnCO_{3}$)火法炼锌|$2ZnCO_{3} + C \stackrel{高温}{=\!=\!=} 2Zn + 3CO\uparrow$|
|B|$CaH_{2}$用作野外生氢剂|$CaH_{2} + 2H_{2}O = Ca(OH)_{2} + 2H_{2}\uparrow$|
|C|饱和$Na_{2}CO_{3}$溶液浸泡锅炉水垢|$CaSO_{4}(s) + CO_{3}^{2 - }(aq) \rightleftharpoons CaCO_{3}(s) + SO_{4}^{2 - }(aq)$|
|D|绿矾($FeSO_{4}·7H_{2}O$)处理酸性工业废水中的$Cr_{2}O_{7}^{2 - }$|$6Fe^{2 + } + Cr_{2}O_{7}^{2 - } + 14H^{+} = 6Fe^{3 + } + 2Cr^{3 + } + 7H_{2}O$|


答案:
A [火法炼锌过程中C作还原剂,$ZnCO_{3}$在高温条件下分解为$ZnO$、$CO_{2}$,$CO_{2}$与C在高温条件下生成还原性气体$CO$,$CO$还原$ZnO$生成$Zn$,因此总反应为$ZnCO_{3}+2C\xlongequal{高温}Zn + 3CO\uparrow$,故A项错误;$CaH_{2}$为活泼金属氢化物,因此能与$H_{2}O$发生归中反应生成碱和氢气,反应的化学方程式为$CaH_{2}+2H_{2}O = Ca(OH)_{2}+2H_{2}\uparrow$,故B项正确;锅炉水垢的主要成分为$CaSO_{4}$、$MgCO_{3}$等,由于溶解性:$CaSO_{4}>CaCO_{3}$,因此向锅炉水垢中加入饱和$Na_{2}CO_{3}$溶液,根据难溶物转化原则可知$CaSO_{4}$转化为$CaCO_{3}$,反应的化学方程式为$CaSO_{4}(s)+CO_{3}^{2 - }(aq)\rightleftharpoons CaCO_{3}(s)+SO_{4}^{2 - }(aq)$,故C正确;$Cr_{2}O_{7}^{2 - }$具有强氧化性,加入具有还原性的$Fe^{2+}$,二者发生氧化还原反应生成$Fe^{3+}$、$Cr^{3+}$,$Cr$元素化合价由 + 6价降低至 + 3价,$Fe$元素化合价由 + 2价升高至 + 3价,则反应的离子方程式为$6Fe^{2+}+Cr_{2}O_{7}^{2 - }+14H^{+}=6Fe^{3+}+2Cr^{3+}+7H_{2}O$,故D正确。]
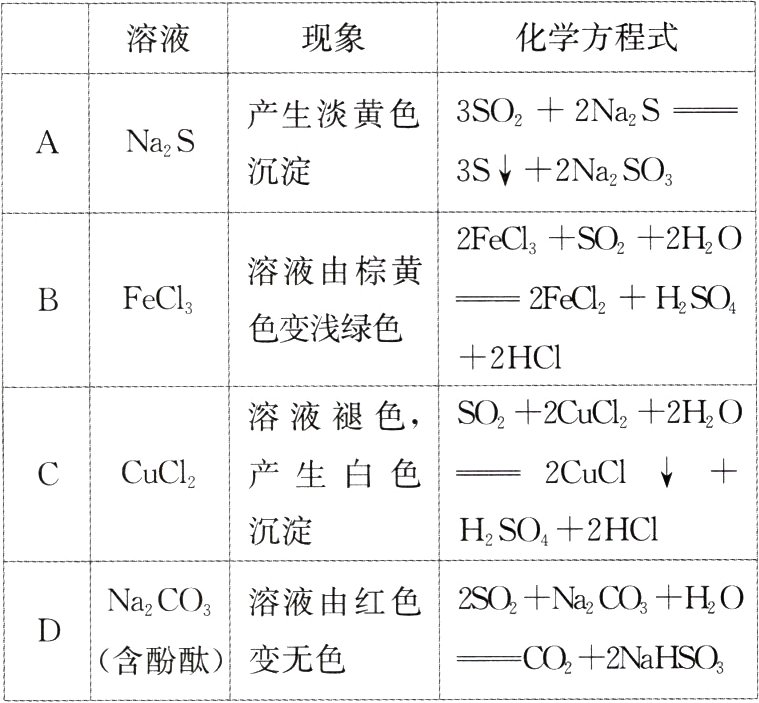
3.(2024·湖北,7)过量$SO_{2}$与以下$0.1mol·L^{-1}$的溶液反应,下列总反应方程式错误的是( )
|溶液|现象|化学方程式|
| ---- | ---- | ---- |
|A|$Na_{2}S$|产生淡黄色沉淀|$3SO_{2} + 2Na_{2}S = 3S\downarrow + 2Na_{2}SO_{3}$|
|B|$FeCl_{3}$|溶液由棕黄色变浅绿色|$2FeCl_{3} + SO_{2} + 2H_{2}O = 2FeCl_{2} + H_{2}SO_{4} + 2HCl$|
|C|$CuCl_{2}$|溶液褪色,产生白色沉淀|$SO_{2} + 2CuCl_{2} + 2H_{2}O = 2CuCl\downarrow + H_{2}SO_{4} + 2HCl$|
|D|$Na_{2}CO_{3}$(含酚酞)|溶液由红色变无色|$2SO_{2} + Na_{2}CO_{3} + H_{2}O = CO_{2} + 2NaHSO_{3}$|
|溶液|现象|化学方程式|
| ---- | ---- | ---- |
|A|$Na_{2}S$|产生淡黄色沉淀|$3SO_{2} + 2Na_{2}S = 3S\downarrow + 2Na_{2}SO_{3}$|
|B|$FeCl_{3}$|溶液由棕黄色变浅绿色|$2FeCl_{3} + SO_{2} + 2H_{2}O = 2FeCl_{2} + H_{2}SO_{4} + 2HCl$|
|C|$CuCl_{2}$|溶液褪色,产生白色沉淀|$SO_{2} + 2CuCl_{2} + 2H_{2}O = 2CuCl\downarrow + H_{2}SO_{4} + 2HCl$|
|D|$Na_{2}CO_{3}$(含酚酞)|溶液由红色变无色|$2SO_{2} + Na_{2}CO_{3} + H_{2}O = CO_{2} + 2NaHSO_{3}$|

答案:
A [过量$SO_{2}$与$0.1mol\cdot L^{-1}$的$Na_{2}S$溶液反应,产生的淡黄色沉淀是S,同时生成$NaHSO_{3}$,总反应化学方程式为$5SO_{2}+2Na_{2}S + 2H_{2}O = 3S\downarrow + 4NaHSO_{3}$,A错误;$Na_{2}CO_{3}$水解使溶液显碱性,其水溶液能使酚酞变红;过量$SO_{2}$与$0.1mol\cdot L^{-1}$的$Na_{2}CO_{3}$溶液反应,生成$CO_{2}$、$NaHSO_{3}$,$NaHSO_{3}$溶液显酸性,滴有酚酞的溶液由红色变无色,总反应的化学方程式为$2SO_{2}+Na_{2}CO_{3}+H_{2}O = CO_{2}+2NaHSO_{3}$,D正确。]
4.(2023·湖南,5)下列有关电极方程式或离子方程式错误的是 ( )
A. 碱性锌锰电池的正极反应:$MnO_{2} + H_{2}O + e^{-} = MnO(OH) + OH^{-}$
B. 铅酸蓄电池充电时的阳极反应:$Pb^{2 + } + 2H_{2}O - 2e^{-} = PbO_{2} + 4H^{+}$
C. $K_{3}[Fe(CN)_{6}]$溶液滴入$FeCl_{2}$溶液中:$K^{+} + Fe^{2 + } + [Fe(CN)_{6}]^{3 - } = KFe[Fe(CN)_{6}]\downarrow$
D. $TiCl_{4}$加入水中:$TiCl_{4} + (x + 2)H_{2}O = TiO_{2}·xH_{2}O\downarrow + 4H^{+} + 4Cl^{-}$
A. 碱性锌锰电池的正极反应:$MnO_{2} + H_{2}O + e^{-} = MnO(OH) + OH^{-}$
B. 铅酸蓄电池充电时的阳极反应:$Pb^{2 + } + 2H_{2}O - 2e^{-} = PbO_{2} + 4H^{+}$
C. $K_{3}[Fe(CN)_{6}]$溶液滴入$FeCl_{2}$溶液中:$K^{+} + Fe^{2 + } + [Fe(CN)_{6}]^{3 - } = KFe[Fe(CN)_{6}]\downarrow$
D. $TiCl_{4}$加入水中:$TiCl_{4} + (x + 2)H_{2}O = TiO_{2}·xH_{2}O\downarrow + 4H^{+} + 4Cl^{-}$
答案:
B [碱性锌锰电池放电时正极得到电子生成$MnO(OH)$,电极反应为$MnO_{2}+H_{2}O + e^{-}=MnO(OH)+OH^{-}$,A正确;铅蓄电池在充电时阳极失电子,发生反应:$PbSO_{4}+2H_{2}O - 2e^{-}=PbO_{2}+4H^{+}+SO_{4}^{2 - }$,B错误;$K_{3}[Fe(CN)_{6}]$溶液与$Fe^{2+}$反应生成蓝色沉淀,反应的离子方程式为$K^{+}+Fe^{2+}+[Fe(CN)_{6}]^{3 - }=KFe[Fe(CN)_{6}]\downarrow$,C正确;$TiCl_{4}$容易发生水解,反应的离子方程式为$TiCl_{4}+(x + 2)H_{2}O = TiO_{2}\cdot xH_{2}O\downarrow + 4H^{+}+4Cl^{-}$,D正确。]
5.(2022·湖南,11改编)下列离子方程式正确的是 ( )
A. $Cl_{2}$通入冷的$NaOH$溶液:$3Cl_{2} + 6OH^{-} = 5Cl^{-} + ClO_{3}^{-} + 3H_{2}O$
B. 用醋酸和淀粉 - KI 溶液检验加碘盐中的$IO_{3}^{-}$:$IO_{3}^{-} + 5I^{-} + 6H^{+} = 3I_{2} + 3H_{2}O$
C. $FeSO_{4}$溶液中加入$H_{2}O_{2}$产生沉淀:$2Fe^{2 + } + H_{2}O_{2} + 4H_{2}O = 2Fe(OH)_{3}\downarrow + 4H^{+}$
D. $NaHCO_{3}$溶液与少量的$Ba(OH)_{2}$溶液混合:$HCO_{3}^{-} + Ba^{2 + } + OH^{-} = BaCO_{3}\downarrow + H_{2}O$
A. $Cl_{2}$通入冷的$NaOH$溶液:$3Cl_{2} + 6OH^{-} = 5Cl^{-} + ClO_{3}^{-} + 3H_{2}O$
B. 用醋酸和淀粉 - KI 溶液检验加碘盐中的$IO_{3}^{-}$:$IO_{3}^{-} + 5I^{-} + 6H^{+} = 3I_{2} + 3H_{2}O$
C. $FeSO_{4}$溶液中加入$H_{2}O_{2}$产生沉淀:$2Fe^{2 + } + H_{2}O_{2} + 4H_{2}O = 2Fe(OH)_{3}\downarrow + 4H^{+}$
D. $NaHCO_{3}$溶液与少量的$Ba(OH)_{2}$溶液混合:$HCO_{3}^{-} + Ba^{2 + } + OH^{-} = BaCO_{3}\downarrow + H_{2}O$
答案:
C [$Cl_{2}$通入冷的$NaOH$溶液中发生反应生成氯化钠和次氯酸钠,离子方程式为$Cl_{2}+2OH^{-}=Cl^{-}+ClO^{-}+H_{2}O$,A不正确;用醋酸和淀粉 - KI溶液检验加碘盐中的$IO_{3}^{-}$的原理是$IO_{3}^{-}$在酸性条件下与$I^{-}$发生归中反应生成$I_{2}$,淀粉遇$I_{2}$变蓝,由于醋酸是弱酸,在离子方程式中不能拆,B不正确;$H_{2}O_{2}$具有较强的氧化性,$FeSO_{4}$溶液中加入$H_{2}O_{2}$产生的沉淀是氢氧化铁,该反应的离子方程式为$2Fe^{2+}+H_{2}O_{2}+4H_{2}O = 2Fe(OH)_{3}\downarrow + 4H^{+}$,C正确;$NaHCO_{3}$溶液与少量的$Ba(OH)_{2}$溶液混合发生反应生成碳酸钡沉淀、碳酸钠和水,该反应的离子方程式为$2HCO_{3}^{-}+Ba^{2+}+2OH^{-}=BaCO_{3}\downarrow +CO_{3}^{2 - }+2H_{2}O$,D不正确。]
查看更多完整答案,请扫码查看


