第5页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
1.(2024·黑吉辽,4)硫及其化合物部分转化关系如图。设$N_{A}$为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2 L SO₂中原子总数为0.5$N_{A}$
B.100 mL 0.1 mol·L⁻¹ Na₂SO₃溶液中,SO₃²⁻数目为0.01$N_{A}$
C.反应①每消耗3.4 g H₂S,生成物中硫原子数目为0.1$N_{A}$
D.反应②每生成1 mol还原产物,转移电子数目为2$N_{A}$

A.标准状况下,11.2 L SO₂中原子总数为0.5$N_{A}$
B.100 mL 0.1 mol·L⁻¹ Na₂SO₃溶液中,SO₃²⁻数目为0.01$N_{A}$
C.反应①每消耗3.4 g H₂S,生成物中硫原子数目为0.1$N_{A}$
D.反应②每生成1 mol还原产物,转移电子数目为2$N_{A}$
答案:
D [标准状况下SO₂为气体,11.2LSO₂的物质的量为0.5mol,共含有1.5mol原子,原子总数为1.5Nₐ,A项错误;SO₃²⁻为弱酸阴离子,其在水中易发生水解,100mL 0.1mol·L⁻¹Na₂SO₃溶液中SO₃²⁻数目小于0.01Nₐ,B项错误;反应①的化学方程式为SO₂ + 2H₂S == 3S↓ + 2H₂O,3.4gH₂S的物质的量为0.1mol,完全反应生成0.15molS,生成物中S原子数目为0.15Nₐ,C项错误;反应②的离子方程式为3S + 6OH⁻ ==△== SO₃²⁻ + 2S²⁻ + 3H₂O,还原产物为S²⁻,S→S²⁻,S化合价降低2,故每生成1mol S²⁻,转移2mol电子,转移电子数目为2Nₐ,D项正确。]
2.(2024·河北,4)超氧化钾(KO₂)可用作潜水或宇航装置的CO₂吸收剂和供氧剂,反应为4KO₂ + 2CO₂ == 2K₂CO₃ + 3O₂,$N_{A}$为阿伏加德罗常数的值。下列说法正确的是( )
A.44 g CO₂中σ键的数目为2$N_{A}$
B.1 mol KO₂晶体中离子的数目为3$N_{A}$
C.1 L 1 mol·L⁻¹ K₂CO₃溶液中CO₃²⁻的数目为$N_{A}$
D.该反应中每转移1 mol电子生成O₂的数目为1.5$N_{A}$
A.44 g CO₂中σ键的数目为2$N_{A}$
B.1 mol KO₂晶体中离子的数目为3$N_{A}$
C.1 L 1 mol·L⁻¹ K₂CO₃溶液中CO₃²⁻的数目为$N_{A}$
D.该反应中每转移1 mol电子生成O₂的数目为1.5$N_{A}$
答案:
A [CO₂的结构式为O == C == O,1个CO₂分子中含有2个σ键,44g即1molCO₂中σ键的数目为2Nₐ,A正确;KO₂由K⁺和O₂⁻构成,1molKO₂晶体中离子的数目为2Nₐ,B错误;CO₃²⁻在水溶液中会发生水解:CO₃²⁻ + H₂O ⇌ HCO₃⁻ + OH⁻,故1L 1mol·L⁻¹K₂CO₃溶液中CO₃²⁻的数目小于Nₐ,C错误;该反应中部分氧元素化合价由 - 1/2价升至0价,部分氧元素化合价由 - 1/2价降至 - 2价,每4molKO₂参加反应转移3mol电子,生成3molO₂,则每转移1mol电子生成O₂的数目为Nₐ,D错误。]
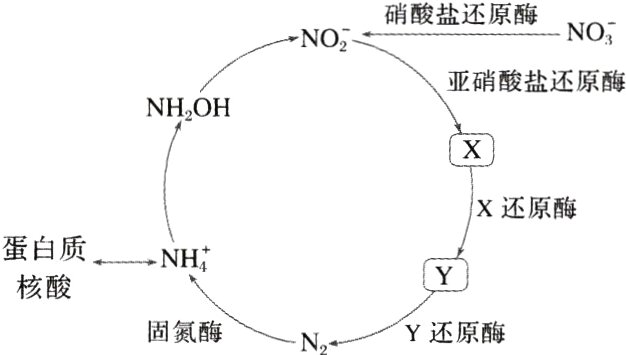
3.(2024·安徽,6)地球上的生物氮循环涉及多种含氮物质,转化关系之一如下图所示(X、Y均为氮氧化物),羟胺(NH₂OH)以中间产物的形式参与循环。常温常压下,羟胺易潮解,水溶液呈碱性,与盐酸反应的产物盐酸羟胺([NH₃OH]Cl)广泛用于药品、香料等的合成。
已知25 ℃时,$K_{a}$(HNO₂)=7.2×10⁻⁴,$K_{b}$(NH₃·H₂O)=1.8×10⁻⁵,$K_{b}$(NH₂OH)=7.7×10⁻⁹。
$N_{A}$是阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24 L X和Y混合气体中氧原子数为0.1$N_{A}$
B.1 L 0.1 mol·L⁻¹ NaNO₂溶液中Na⁺和NO₂⁻数均为0.1$N_{A}$
C.3.3 g NH₂OH完全转化为NO₂⁻时,转移的电子数为0.6$N_{A}$
D.2.8 g N₂中含有的价电子总数为0.6$N_{A}$
已知25 ℃时,$K_{a}$(HNO₂)=7.2×10⁻⁴,$K_{b}$(NH₃·H₂O)=1.8×10⁻⁵,$K_{b}$(NH₂OH)=7.7×10⁻⁹。
$N_{A}$是阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24 L X和Y混合气体中氧原子数为0.1$N_{A}$
B.1 L 0.1 mol·L⁻¹ NaNO₂溶液中Na⁺和NO₂⁻数均为0.1$N_{A}$
C.3.3 g NH₂OH完全转化为NO₂⁻时,转移的电子数为0.6$N_{A}$
D.2.8 g N₂中含有的价电子总数为0.6$N_{A}$
答案:
A [NO在亚硝酸钠还原酶的作用下转化为X,X在X还原酶的作用下转化为Y,X、Y均为氮氧化物,即X为NO,Y为N₂O。标准状况下,2.24LNO和N₂O混合气体的物质的量为0.1mol,氧原子数为0.1Nₐ,A项正确;HNO₂为弱酸,NO₂⁻能够水解为HNO₂,1L 0.1mol·L⁻¹NaNO₂溶液中NO₂⁻的数目小于0.1Nₐ,B项错误;NH₂OH完全转化为NO₂⁻时,N元素的化合价由 - 1价升高到 + 3价,3.3gNH₂OH的物质的量为0.1mol,转移的电子数为0.4Nₐ,C项错误;2.8gN₂的物质的量为0.1mol,N的价电子数为5,故2.8gN₂含有的价电子总数为Nₐ,D项错误。]
4.(2023·辽宁,5)我国古代四大发明之一黑火药的爆炸反应为:S + 2KNO₃ + 3C == K₂S + N₂↑ + 3CO₂↑。设$N_{A}$为阿伏加德罗常数的值,下列说法正确的是( )
A.11.2 L CO₂含π键数目为$N_{A}$
B.每生成2.8 g N₂转移电子数目为$N_{A}$
C.0.1 mol KNO₃晶体中含离子数目为0.2$N_{A}$
D.1 L 0.1 mol·L⁻¹ K₂S溶液中含S²⁻数目为0.1$N_{A}$
A.11.2 L CO₂含π键数目为$N_{A}$
B.每生成2.8 g N₂转移电子数目为$N_{A}$
C.0.1 mol KNO₃晶体中含离子数目为0.2$N_{A}$
D.1 L 0.1 mol·L⁻¹ K₂S溶液中含S²⁻数目为0.1$N_{A}$
答案:
C [题中没有说是标况条件下,气体摩尔体积未知,无法计算π键个数,A项错误;2.8gN₂的物质的量为0.1mol,生成1molN₂转移的电子数为12Nₐ,则生成0.1molN₂转移的电子数为1.2Nₐ,B项错误;因为S²⁻水解使溶液中S²⁻的数目小于0.1Nₐ,D项错误。
例1 写出亚硫酰氯($SOCl_{2}$)在潮湿的空气中产生白雾的化学方程式:______________________________。
答案:
$SOCl_{2}+H_{2}O=SO_{2}\uparrow +2HCl\uparrow$
解析

$SOCl_{2}+H_{2}O=SO_{2}\uparrow +2HCl\uparrow$
解析

例2 常用尿素$[CO(NH_{2})_{2}]$除去工业废水中$Cr^{3 + }$,流程为:含$Cr^{3 + }$废水$\xrightarrow{尿素} \begin{cases} CO_{2}\uparrow \\ Cr(OH)_{3}\downarrow \\ 滤液 \end{cases}$,完成该转化的离子方程式:______________________________。
答案:
$2Cr^{3+}+3CO(NH_{2})_{2}+9H_{2}O=2Cr(OH)_{3}\downarrow +3CO_{2}\uparrow +6NH_{4}^{+}$
例3 根据要求完成下列化学方程式:
(1)$25\ ^{\circ }C$,$H_{2}C_{2}O_{4}$和$HF$两种酸的电离平衡常数如下:

则$H_{2}C_{2}O_{4}$溶液和$NaF$溶液反应的离子方程式为______________________________。
(2) 多硼酸盐四硼酸钠($Na_{2}B_{4}O_{7}$)与硫酸反应可制硼酸($H_{3}BO_{3}$),写出反应的化学方程式:__________。
解题思路 (1) 判断三种酸(只看一步电离)$H_{2}C_{2}O_{4}$、$HF$、$HC_{2}O_{4}^{-}$电离$H^{ + }$的能力,即酸性的强弱,运用强酸制弱酸即可写出方程式。
(2) 联想$Na_{2}SiO_{3}$与酸的反应,$H_{3}BO_{3}$是弱酸。
(1)$25\ ^{\circ }C$,$H_{2}C_{2}O_{4}$和$HF$两种酸的电离平衡常数如下:

则$H_{2}C_{2}O_{4}$溶液和$NaF$溶液反应的离子方程式为______________________________。
(2) 多硼酸盐四硼酸钠($Na_{2}B_{4}O_{7}$)与硫酸反应可制硼酸($H_{3}BO_{3}$),写出反应的化学方程式:__________。
解题思路 (1) 判断三种酸(只看一步电离)$H_{2}C_{2}O_{4}$、$HF$、$HC_{2}O_{4}^{-}$电离$H^{ + }$的能力,即酸性的强弱,运用强酸制弱酸即可写出方程式。
(2) 联想$Na_{2}SiO_{3}$与酸的反应,$H_{3}BO_{3}$是弱酸。
答案:
(1)$H_{2}C_{2}O_{4}+F^{-}=HF+HC_{2}O_{4}^{-}$
(2)$Na_{2}B_{4}O_{7}+H_{2}SO_{4}+5H_{2}O=Na_{2}SO_{4}+4H_{3}BO_{3}$
解析
(1)由 $K_{a}$ 可知酸性:$H_{2}C_{2}O_{4}>HF>HC_{2}O_{4}^{-}$。
(1)$H_{2}C_{2}O_{4}+F^{-}=HF+HC_{2}O_{4}^{-}$
(2)$Na_{2}B_{4}O_{7}+H_{2}SO_{4}+5H_{2}O=Na_{2}SO_{4}+4H_{3}BO_{3}$
解析
(1)由 $K_{a}$ 可知酸性:$H_{2}C_{2}O_{4}>HF>HC_{2}O_{4}^{-}$。
查看更多完整答案,请扫码查看


