第26页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
3.(2024·湖北,9)主族元素W、X、Y、Z原子序数依次增大,X、Y的价电子数相等,Z的价电子所在能层有16个轨道,4种元素形成的化合物如图。下列说法正确的是( )
A. 电负性:$W>Y$
B. 酸性:$W_{2}YX_{3}>W_{2}YX_{4}$
C. 基态原子的未成对电子数:$W>X$
D. 氧化物溶于水所得溶液的$pH$:$Z>Y$
A. 电负性:$W>Y$
B. 酸性:$W_{2}YX_{3}>W_{2}YX_{4}$
C. 基态原子的未成对电子数:$W>X$
D. 氧化物溶于水所得溶液的$pH$:$Z>Y$
答案:
3. D [主族元素 W、X、Y、Z 原子序数依次增大,Z 的价电子所在能层有 16 个轨道,则 Z 有 4 个能层,且形成+1 价离子,应为 K;在此结构中 W 形成一个化学键,应为 H;X、Y 的价电子数相等,且 X 形成两个化学键、Y 形成六个化学键,可推知 X、Y 分别为 O、S。W 和 Y 可以形成 H₂S,其中 S 显-2 价,电负性:S>H,A 错误;H₂SO₃是中强酸,而 H₂SO₄是强酸,在相同条件下后者的酸性较强,B 错误;H 只有 1 个电子,O 的 2p 轨道上有 4 个电子,有 2 个未成对电子,基态原子的未成对电子数:O>H,C 错误;K 的氧化物溶于水且与水反应生成强碱 KOH,S 的氧化物溶于水且与水反应生成 H₂SO₃或 H₂SO₄,氧化物溶于水所得溶液的 pH 的大小关系为 K>S,D 正确。]
4.(2023·湖北,6)W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,$Z_{2}$是氧化性最强的单质,4种元素可形成离子化合物$(XY)^{+}(WZ_{4})^{-}$。下列说法正确的是( )
A. 分子的极性:$WZ_{3}<XZ_{3}$
B. 第一电离能:$X<Y<Z$
C. 氧化性:$X_{2}Y_{3}<W_{2}Y_{3}$
D. 键能:$X_{2}<Y_{2}<Z_{2}$
A. 分子的极性:$WZ_{3}<XZ_{3}$
B. 第一电离能:$X<Y<Z$
C. 氧化性:$X_{2}Y_{3}<W_{2}Y_{3}$
D. 键能:$X_{2}<Y_{2}<Z_{2}$
答案:
4. A [分析可知,W 为 B,X 为 N,Y 为 O,Z 为 F。BF₃为非极性分子,NF₃为极性分子,则分子的极性:WZ₃<XZ₃,A 正确;同一周期元素从左到右,第一电离能呈增大趋势,但是 N 的价层电子排布为 2s²2p³,为半满稳定结构,其第一电离能大于同周期相邻元素,则第一电离能:Y<X<Z,B 错误;N 的非金属性更强一些,故 N₂O₅的氧化性更强一些,C 错误;N 对应的单质为氮气,含有三键,键能最大,D 错误。]
5.(2023·湖南,6)日光灯中用到的某种荧光粉的主要成分为$3W_{3}(ZX_{4})_{2}\cdot WY_{2}$。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2∶1∶3。下列说法正确的是( )
A. 电负性:$X>Y>Z>W$
B. 原子半径:$X<Y<Z<W$
C. Y和W的单质都能与水反应生成气体
D. Z元素最高价氧化物对应的水化物具有强氧化性
A. 电负性:$X>Y>Z>W$
B. 原子半径:$X<Y<Z<W$
C. Y和W的单质都能与水反应生成气体
D. Z元素最高价氧化物对应的水化物具有强氧化性
答案:
5. C [分析可得 X、Y、Z、W 分别为 O、F、P、Ca。同一周期元素,从左到右电负性依次增大,同一主族元素,从上到下电负性依次减小,故四种元素的电负性大小为 Y>X>Z>W,A 错误;同一周期元素原子半径从左到右依次减小,同一主族元素原子半径从上到下依次增大,故四种元素的原子半径大小为 Y<X<Z<W,B 错误;F₂与水反应生成 HF 和 O₂,Ca 与水反应生成氢氧化钙和氢气,均可以生成气体,C 正确;Z 元素的最高价氧化物对应的水化物为 H₃PO₄,不具有强氧化性,D 错误。]
6.(2023·辽宁,9)某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价层电子数是Q原子价层电子数的2倍。下列说法错误的是( )
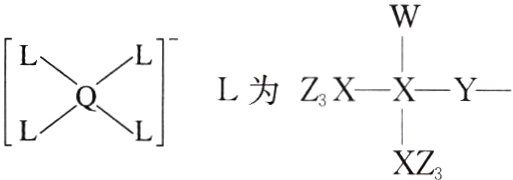
A. W与X的化合物为极性分子
B. 第一电离能:$Z>Y>X$
C. Q的氧化物是两性氧化物
D. 该阴离子中含有配位键
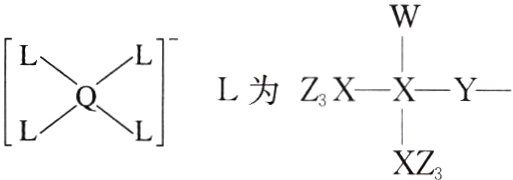
A. W与X的化合物为极性分子
B. 第一电离能:$Z>Y>X$
C. Q的氧化物是两性氧化物
D. 该阴离子中含有配位键
答案:
6. A [由题干分析知,W 为 H,X 为 C,Y 为 O,Z 为 F,Q 为 Al。]
7.(2023·福建,4)某含锰着色剂的化学式为$XY_{4}MnZ_{2}Q_{4}$,$Y、X、Q、Z$为原子序数依次增大的短周期元素,其中$XY_{4}^{+}$具有正四面体空间结构,$Z_{2}Q_{7}^{2 - }$结构如图所示。下列说法正确的是( )
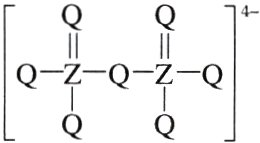
A. 键角:$XY_{3}>XY_{4}^{+}$
B. 简单氢化物沸点:$X>Q>Z$
C. 第一电离能:$X>Q>Mn$
D. 最高价氧化物对应的水化物酸性:$Z>X$

A. 键角:$XY_{3}>XY_{4}^{+}$
B. 简单氢化物沸点:$X>Q>Z$
C. 第一电离能:$X>Q>Mn$
D. 最高价氧化物对应的水化物酸性:$Z>X$
答案:
7. C [由题意,可知 XY₄⁺为 NH₄⁺,故 Y 为 H,X 为 N;同时分析 Z₂Q₇²⁻结构,可知 Q 正常情况应该成两个键,Q 为第ⅥA 族的元素,同时 Z 也成 5 个键,Z 为第ⅤA 族的元素,故 Q 为 O,Z 为 P。NH₃和 NH₄⁺都是 sp³杂化,但是 NH₃的中心原子上有一个孤电子对,孤电子对对成键电子对的排斥作用更大,NH₃是三角锥形结构,而 NH₄⁺是正四面体结构,故键角:NH₃<NH₄⁺,A 错误;X、Q、Z 分别为 N、O、P,沸点顺序为 H₂O>NH₃>PH₃,即 Q>X>Z,B 错误;同主族元素从上到下第一电离能逐渐减小,同周期元素从左到右第一电离能有增大的趋势,但第ⅡA、ⅤA 族元素异常,故第一电离能:N>O>Mn,C 正确;Z 的最高价氧化物对应的水化物为 H₃PO₄,X 最高价氧化物对应的水化物为 HNO₃,前者为中强酸而后者为强酸,D 错误。]
查看更多完整答案,请扫码查看


