第44页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
5. (2024·湖南,14)恒压下,向某密闭容器中充入一定量的$CH_{3}OH(g)$和CO(g),发生如下反应:
主反应:$CH_{3}OH(g)+CO(g)=CH_{3}COOH(g)$ $\Delta H_{1}$
副反应:$CH_{3}OH(g)+CH_{3}COOH(g)=CH_{3}COOCH_{3}(g)+H_{2}O(g)$ $\Delta H_{2}$
在不同温度下,反应达到平衡时,测得两种含碳产物的分布分数$\delta [\delta (CH_{3}COOH)=\frac{n(CH_{3}COOH)}{n(CH_{3}COOH)+n(CH_{3}COOCH_{3})}]$随投料比x(物质的量之比)的变化关系如图所示,下列说法正确的是 ( )
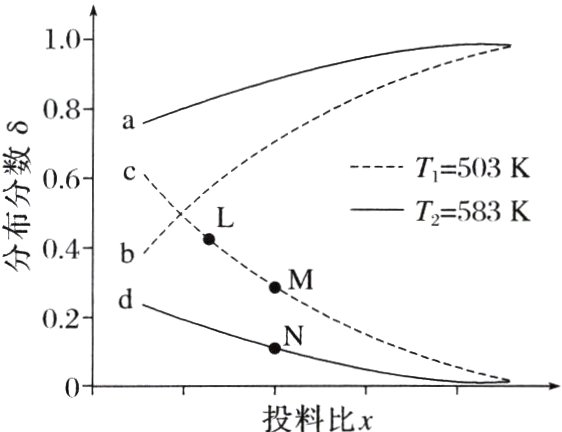
A. 投料比x代表$\frac{n(CH_{3}OH)}{n(CO)}$
B. 曲线c代表乙酸的分布分数
C. $\Delta H_{1}<0$,$\Delta H_{2}>0$
D. L、M、N三点的平衡常数:$K(L)=K(M)>K(N)$
主反应:$CH_{3}OH(g)+CO(g)=CH_{3}COOH(g)$ $\Delta H_{1}$
副反应:$CH_{3}OH(g)+CH_{3}COOH(g)=CH_{3}COOCH_{3}(g)+H_{2}O(g)$ $\Delta H_{2}$
在不同温度下,反应达到平衡时,测得两种含碳产物的分布分数$\delta [\delta (CH_{3}COOH)=\frac{n(CH_{3}COOH)}{n(CH_{3}COOH)+n(CH_{3}COOCH_{3})}]$随投料比x(物质的量之比)的变化关系如图所示,下列说法正确的是 ( )

A. 投料比x代表$\frac{n(CH_{3}OH)}{n(CO)}$
B. 曲线c代表乙酸的分布分数
C. $\Delta H_{1}<0$,$\Delta H_{2}>0$
D. L、M、N三点的平衡常数:$K(L)=K(M)>K(N)$
答案:
D [图中曲线表示的是两种含碳产物的分布分数即δ(CH₃COOH)、δ(CH₃COOCH₃),结合主、副反应可知,x代表$\frac{n(CO)}{n(CH₃OH)}$,曲线a或曲线b表示CH₃COOH分布分数,曲线c或曲线d表示CH₃COOCH₃分布分数,故A、B错误;曲线a或曲线b表示δ(CH₃COOH),由图像可知,当$\frac{n(CO)}{n(CH₃OH)}$相同时,T₂>T₁,T₂时δ(CH₃COOH)大于T₁时,说明升高温度主反应的平衡正向移动,故ΔH₁>0;同理,T₁时δ(CH₃COOCH₃)大于T₂时,说明升高温度副反应的平衡逆向移动,故ΔH₂<0,C错误;L、M、N三点对应副反应ΔH₂<0,且Tₙ>Tₘ = Tₗ,升高温度平衡逆向移动,故K(L)>K(M)>K(N),D正确。]
6. (2023·辽宁,12)一定条件下,酸性$KMnO_{4}$溶液与$H_{2}C_{2}O_{4}$发生反应,Mn(Ⅱ)起催化作用,过程中不同价态含Mn粒子的浓度随时间变化如图所示。下列说法正确的是 ( )
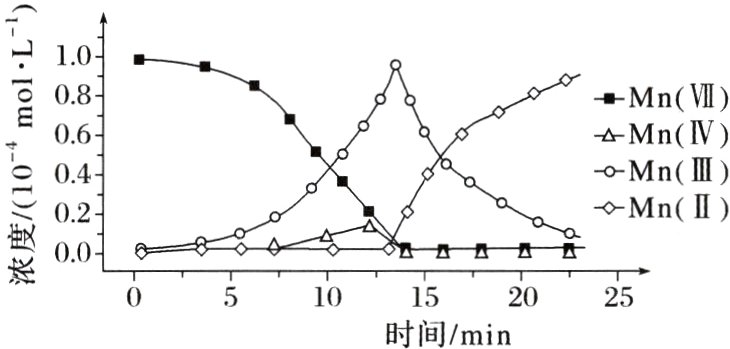
A. Mn(Ⅲ)不能氧化$H_{2}C_{2}O_{4}$
B. 随着反应物浓度的减小,反应速率逐渐减小
C. 该条件下,Mn(Ⅱ)和Mn(Ⅶ)不能大量共存
D. 总反应为:$2MnO_{4}^{-}+5C_{2}O_{4}^{2 - }+16H^{+}=2Mn^{2 + }+10CO_{2}\uparrow +8H_{2}O$

A. Mn(Ⅲ)不能氧化$H_{2}C_{2}O_{4}$
B. 随着反应物浓度的减小,反应速率逐渐减小
C. 该条件下,Mn(Ⅱ)和Mn(Ⅶ)不能大量共存
D. 总反应为:$2MnO_{4}^{-}+5C_{2}O_{4}^{2 - }+16H^{+}=2Mn^{2 + }+10CO_{2}\uparrow +8H_{2}O$
答案:
C [由图像可知,随着时间的推移,Mn(Ⅲ)的浓度先增大后减小,说明开始反应生成Mn(Ⅲ),后Mn(Ⅲ)被消耗生成Mn(Ⅱ),Mn(Ⅲ)能氧化H₂C₂O₄,A项错误;随着反应物浓度的减小,到大约13 min时开始生成Mn(Ⅱ),Mn(Ⅱ)对反应起催化作用,13 min后反应速率会增大,B项错误;由图像可知,Mn(Ⅶ)的浓度为0后才开始生成Mn(Ⅱ),该条件下Mn(Ⅱ)和Mn(Ⅶ)不能大量共存,C项正确;H₂C₂O₄为弱酸,在离子方程式中不拆成离子,总反应为2MnO₄⁻ + 5H₂C₂O₄ + 6H⁺ = 2Mn²⁺ + 10CO₂↑ + 8H₂O,D项错误。]
7. (2023·湖南,13)向一恒容密闭容器中加入1 mol $CH_{4}$和一定量的$H_{2}O$,发生反应:$CH_{4}(g)+H_{2}O(g)\rightleftharpoons CO(g)+3H_{2}(g)$。$CH_{4}$的平衡转化率按不同投料比$x[x = \frac{n(CH_{4})}{n(H_{2}O)}]$随温度的变化曲线如图所示。下列说法错误的是 ( )
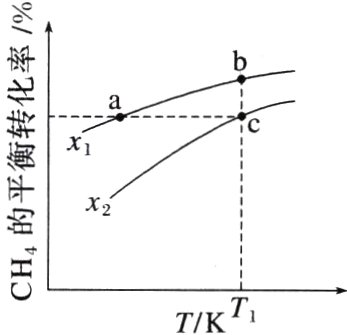
A. $x_{1}\lt x_{2}$
B. 反应速率:$v_{b正}\lt v_{c正}$
C. 点a、b、c对应的平衡常数:$K_{a}\lt K_{b}=K_{c}$
D. 反应温度为$T_{1}$,当容器内压强不变时,反应达到平衡状态

A. $x_{1}\lt x_{2}$
B. 反应速率:$v_{b正}\lt v_{c正}$
C. 点a、b、c对应的平衡常数:$K_{a}\lt K_{b}=K_{c}$
D. 反应温度为$T_{1}$,当容器内压强不变时,反应达到平衡状态
答案:
B [一定条件下,增大H₂O(g)的浓度,能提高CH₄的转化率,即x值越小,CH₄的转化率越大,则x₁<x₂,故A正确;b点和c点温度相同,CH₄的起始物质的量都是1 mol,b点x值小于c点,则b点H₂O(g)多,反应物浓度大,则反应速率:v₍b正₎>v₍c正₎,故B错误;由图像可知,x一定时,温度升高CH₄的平衡转化率增大,说明正反应为吸热反应,温度升高平衡正向移动,K增大,温度相同,K不变,则点a、b、c对应的平衡常数:Kₐ<Kb = Kc,故C正确;该反应为气体分子数增大的反应,反应进行时压强发生改变,所以温度一定时,当容器内压强不变时,反应达到平衡状态,故D正确。]
8. (2022·湖南,14改编)压强向体积均为1 L的两恒容容器中分别充入2 mol X和1 mol Y发生反应:$2X(g)+Y(g)\rightleftharpoons Z(g)$ $\Delta H$,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是 ( )
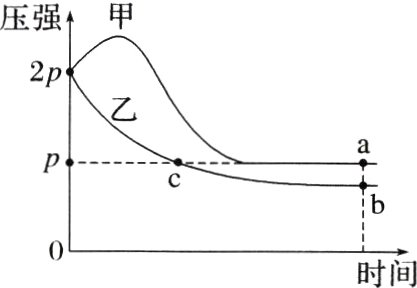
A. $\Delta H>0$
B. 气体的总物质的量:$n_{a}\lt n_{c}$
C. a点平衡常数:$K<12$
D. 反应速率:$v_{a正}\lt v_{b正}$

A. $\Delta H>0$
B. 气体的总物质的量:$n_{a}\lt n_{c}$
C. a点平衡常数:$K<12$
D. 反应速率:$v_{a正}\lt v_{b正}$
答案:
B [甲容器在绝热条件下,随着反应的进行,压强先增大后减小,正反应为气体分子数减小的反应,则刚开始压强增大的原因是因为容器温度升高,说明反应放热,即ΔH<0,故A错误;根据A项分析可知,密闭容器中的反应为放热反应,因甲容器为绝热过程,乙容器为恒温过程,若两者气体的总物质的量相等,则甲容器压强大于乙容器压强,图中a点和c点的压强相等,则气体的总物质的量:nₐ<nₑ,故B正确;设Y转化的物质的量浓度为x mol·L⁻¹,则列出三段式如下:
2X(g) + Y(g)⇌Z(g)
c₀ 2 1 0
Δc 2x x x
cₑ 2 - 2x 1 - x x
则有[(2 - 2x)+(1 - x)+x]mol<$\frac{1}{2}$×3 mol,计算得到x>0.75,即平衡常数K>12,故C错误;根据图像可知,甲容器达到平衡的时间短,温度高,所以达到平衡的速率相对乙容器的快,即v₍a正₎>v₍b正₎,故D错误。]
2X(g) + Y(g)⇌Z(g)
c₀ 2 1 0
Δc 2x x x
cₑ 2 - 2x 1 - x x
则有[(2 - 2x)+(1 - x)+x]mol<$\frac{1}{2}$×3 mol,计算得到x>0.75,即平衡常数K>12,故C错误;根据图像可知,甲容器达到平衡的时间短,温度高,所以达到平衡的速率相对乙容器的快,即v₍a正₎>v₍b正₎,故D错误。]
查看更多完整答案,请扫码查看


