第30页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
7.(2024·河北,13)我国科技工作者设计了如图所示的可充电Mg - CO₂电池,以Mg(TFSI)₂为电解质,电解液中加入1,3 - 丙二胺(PDA)以捕获CO₂,使放电时CO₂还原产物为MgC₂O₄。该设计克服了MgCO₃导电性差和释放CO₂能力差的障碍,同时改善了Mg²⁺的溶剂化环境,提高了电池充放电循环性能。
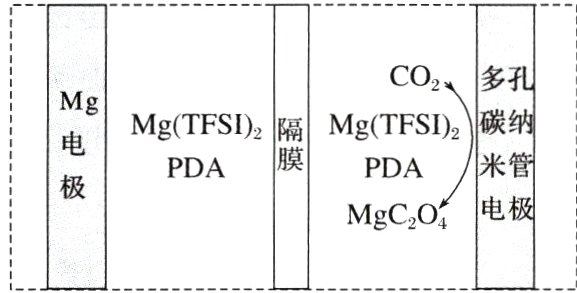
下列说法错误的是 ( )
A. 放电时,电池总反应为2CO₂ + Mg = MgC₂O₄
B. 充电时,多孔碳纳米管电极与电源正极连接
C. 充电时,电子由Mg电极流向阳极,Mg²⁺向阴极迁移
D. 放电时,每转移1 mol电子,理论上可转化1 mol CO₂

下列说法错误的是 ( )
A. 放电时,电池总反应为2CO₂ + Mg = MgC₂O₄
B. 充电时,多孔碳纳米管电极与电源正极连接
C. 充电时,电子由Mg电极流向阳极,Mg²⁺向阴极迁移
D. 放电时,每转移1 mol电子,理论上可转化1 mol CO₂
答案:
C [放电时$CO_{2}$转化为$MgC_{2}O_{4}$,碳元素化合价由$ + 4$价降低为$ + 3$价,发生还原反应,所以多孔碳纳米管电极为正极,电极反应式为$Mg^{2 + }+2CO_{2}+2e^{-}=MgC_{2}O_{4}$,$Mg$电极为负极,电极反应式为$Mg - 2e^{-}=Mg^{2 + }$,则放电时电池总反应为$2CO_{2}+Mg=MgC_{2}O_{4}$,A正确;充电时,多孔碳纳米管电极上发生氧化反应,为阳极,与电源正极连接,B正确;充电时,$Mg$电极为阴极,电子从电源负极经外电路流向$Mg$电极,同时$Mg^{2 + }$向阴极移动,C错误;根据放电时的电极总反应$2CO_{2}+Mg=MgC_{2}O_{4}$可知,每转移$1mol$电子,理论上可转化$1molCO_{2}$,D正确。]
8.(2024·安徽,11)我国学者研发出一种新型水系锌电池,其示意图如下。该电池分别以Zn - TCPP(局部结构如标注框内所示)形成的稳定超分子材料和Zn为电极,以ZnSO₄和KI混合液为电解质溶液。下列说法错误的是( )
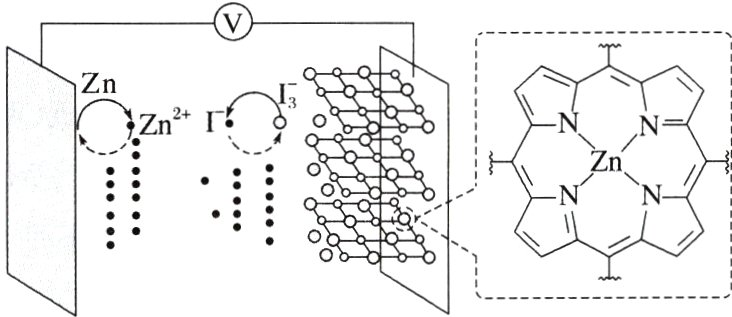
A. 标注框内所示结构中存在共价键和配位键
B. 电池总反应为:I₃⁻ + Zn $\underset{充电}{\overset{放电}{\rightleftharpoons}}$ Zn²⁺ + 3I⁻
C. 充电时,阴极被还原的Zn²⁺主要来自Zn - TCPP
D. 放电时,消耗0.65 g Zn,理论上转移0.02 mol电子

A. 标注框内所示结构中存在共价键和配位键
B. 电池总反应为:I₃⁻ + Zn $\underset{充电}{\overset{放电}{\rightleftharpoons}}$ Zn²⁺ + 3I⁻
C. 充电时,阴极被还原的Zn²⁺主要来自Zn - TCPP
D. 放电时,消耗0.65 g Zn,理论上转移0.02 mol电子
答案:
C [由标注框内所示结构可知,其结构中存在碳碳单键、碳碳双键等多种共价键,还有由$N$提供孤电子对、$Zn^{2 + }$提供空轨道形成的配位键,A项正确;由图可知,该新型水系锌电池的负极是锌,正极是超分子材料,负极的电极反应式为$Zn - 2e^{-}=Zn^{2 + }$,则充电时,该电极为阴极,电极反应式为$Zn^{2 + }+2e^{-}=Zn$;正极电极反应式为$I_{3}^{-}+2e^{-}=3I^{-}$,则充电时,该电极为阳极,电极反应式为$3I^{-}-2e^{-}=I_{3}^{-}$,则该电池总反应为$I_{3}^{-}+Zn\underset{充电}{\overset{放电}{\rightleftharpoons }}Zn^{2 + }+3I^{-}$,B项正确;充电时,阴极电极反应式为$Zn^{2 + }+2e^{-}=Zn$,被还原的$Zn^{2 + }$主要来自电解质溶液,C错误;放电时,负极的电极反应式为$Zn - 2e^{-}=Zn^{2 + }$,因此消耗$0.65g$(即$0.01mol$)$Zn$,理论上转移$0.02mol$电子,D正确。]
9.(2023·山东,11改编)利用热再生氨电池可实现CuSO₄电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的CuSO₄电镀废液,向甲室加入足量氨水后电池开始工作。
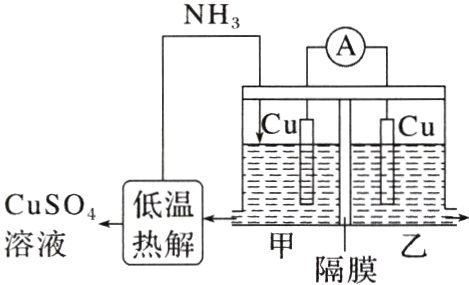
下列说法不正确的是 ( )
A. 甲室Cu电极为负极
B. 隔膜为阳离子膜
C. 电池总反应:Cu²⁺ + 4NH₃ = [Cu(NH₃)₄]²⁺
D. NH₃扩散到乙室将对电池电动势产生影响

下列说法不正确的是 ( )
A. 甲室Cu电极为负极
B. 隔膜为阳离子膜
C. 电池总反应:Cu²⁺ + 4NH₃ = [Cu(NH₃)₄]²⁺
D. NH₃扩散到乙室将对电池电动势产生影响
答案:
B [向甲室加入足量氨水后电池开始工作,则甲室$Cu$电极溶解,变为铜离子与氨形成$[Cu(NH_{3})_{4}]^{2 + }$,因此甲室$Cu$电极为负极,故A正确;原电池内电路中阳离子向正极移动,若隔膜为阳离子膜,电极溶解生成的铜离子要向右侧移动,通入氨水要消耗铜离子,显然左侧阳离子不断减小,明显不利于电池反应正向进行,故B错误;负极反应是$Cu - 2e^{-}+4NH_{3}=[Cu(NH_{3})_{4}]^{2 + }$,正极反应是$Cu^{2 + }+2e^{-}=Cu$,则电池总反应为$Cu^{2 + }+4NH_{3}=[Cu(NH_{3})_{4}]^{2 + }$,故C正确;$NH_{3}$扩散到乙室会与铜离子反应生成$[Cu(NH_{3})_{4}]^{2 + }$,铜离子浓度降低,铜离子得电子能力减弱,因此将对电池电动势产生影响,故D正确。]
10.(2023·河北,7)我国科学家发明了一种以 K和MnO₂为电极材料的新型电池,其内部结构如图所示,其中①区、②区、③区电解质溶液的酸碱性不同。放电时,电极材料
K和MnO₂为电极材料的新型电池,其内部结构如图所示,其中①区、②区、③区电解质溶液的酸碱性不同。放电时,电极材料
下列说法错误的是 ( )

A. 充电时,b电极上发生还原反应
B. 充电时,外电源的正极连接b电极
C. 放电时,①区溶液中的SO₄²⁻向②区迁移
D. 放电时,a电极的电极反应式为MnO₂ + 4H⁺ + 2e⁻ = Mn²⁺ + 2H₂O
 K和MnO₂为电极材料的新型电池,其内部结构如图所示,其中①区、②区、③区电解质溶液的酸碱性不同。放电时,电极材料
K和MnO₂为电极材料的新型电池,其内部结构如图所示,其中①区、②区、③区电解质溶液的酸碱性不同。放电时,电极材料
下列说法错误的是 ( )

A. 充电时,b电极上发生还原反应
B. 充电时,外电源的正极连接b电极
C. 放电时,①区溶液中的SO₄²⁻向②区迁移
D. 放电时,a电极的电极反应式为MnO₂ + 4H⁺ + 2e⁻ = Mn²⁺ + 2H₂O
答案:
B [放电时,电极材料$K$ $K$转化为
$K$转化为  ,电极反应为$K$
,电极反应为$K$  $K - 2ne^{-}= $
$K - 2ne^{-}= $  $+2nK^{+}$,是原电池的负极,阳离子增多需要通过阳离子交换膜进入②区;二氧化锰得到电子变成锰离子,是原电池的正极,电极反应:$MnO_{2}+4H^{+}+2e^{-}=Mn^{2 + }+2H_{2}O$,阳离子减少,多余的阴离子需要通过阴离子交换膜进入②区,故③区为碱性溶液,$b$电极是$K$
$+2nK^{+}$,是原电池的负极,阳离子增多需要通过阳离子交换膜进入②区;二氧化锰得到电子变成锰离子,是原电池的正极,电极反应:$MnO_{2}+4H^{+}+2e^{-}=Mn^{2 + }+2H_{2}O$,阳离子减少,多余的阴离子需要通过阴离子交换膜进入②区,故③区为碱性溶液,$b$电极是$K$  $K$电极,①区为酸性溶液,$a$电极是二氧化锰电极。充电时,$b$电极上得到电子,发生还原反应,A正确;充电时,外电源的正极连接$a$电极,电极失去电子,电极反应为$Mn^{2 + }+2H_{2}O - 2e^{-}=MnO_{2}+4H^{+}$,B错误;放电时,①区溶液中多余的$SO_{4}^{2 - }$向②区迁移,C正确。]
$K$电极,①区为酸性溶液,$a$电极是二氧化锰电极。充电时,$b$电极上得到电子,发生还原反应,A正确;充电时,外电源的正极连接$a$电极,电极失去电子,电极反应为$Mn^{2 + }+2H_{2}O - 2e^{-}=MnO_{2}+4H^{+}$,B错误;放电时,①区溶液中多余的$SO_{4}^{2 - }$向②区迁移,C正确。]
B [放电时,电极材料$K$
 $K$转化为
$K$转化为  ,电极反应为$K$
,电极反应为$K$  $K - 2ne^{-}= $
$K - 2ne^{-}= $  $+2nK^{+}$,是原电池的负极,阳离子增多需要通过阳离子交换膜进入②区;二氧化锰得到电子变成锰离子,是原电池的正极,电极反应:$MnO_{2}+4H^{+}+2e^{-}=Mn^{2 + }+2H_{2}O$,阳离子减少,多余的阴离子需要通过阴离子交换膜进入②区,故③区为碱性溶液,$b$电极是$K$
$+2nK^{+}$,是原电池的负极,阳离子增多需要通过阳离子交换膜进入②区;二氧化锰得到电子变成锰离子,是原电池的正极,电极反应:$MnO_{2}+4H^{+}+2e^{-}=Mn^{2 + }+2H_{2}O$,阳离子减少,多余的阴离子需要通过阴离子交换膜进入②区,故③区为碱性溶液,$b$电极是$K$  $K$电极,①区为酸性溶液,$a$电极是二氧化锰电极。充电时,$b$电极上得到电子,发生还原反应,A正确;充电时,外电源的正极连接$a$电极,电极失去电子,电极反应为$Mn^{2 + }+2H_{2}O - 2e^{-}=MnO_{2}+4H^{+}$,B错误;放电时,①区溶液中多余的$SO_{4}^{2 - }$向②区迁移,C正确。]
$K$电极,①区为酸性溶液,$a$电极是二氧化锰电极。充电时,$b$电极上得到电子,发生还原反应,A正确;充电时,外电源的正极连接$a$电极,电极失去电子,电极反应为$Mn^{2 + }+2H_{2}O - 2e^{-}=MnO_{2}+4H^{+}$,B错误;放电时,①区溶液中多余的$SO_{4}^{2 - }$向②区迁移,C正确。] 查看更多完整答案,请扫码查看


