第54页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
1.(2024·贵州,12)硼砂$[Na_{2}B_{4}O_{5}(OH)_{4}·8H_{2}O]$水溶液常用于pH计的校准。硼砂水解生成等物质的量的$B(OH)_{3}$(硼酸)和$Na[B(OH)_{4}]$(硼酸钠)。
已知:①$25^{\circ}C$时,硼酸显酸性的原理$B(OH)_{3}+2H_{2}O \rightleftharpoons H_{3}O^{+}+$ ,$K_{a}=5.8×10^{-10}$,②$\lg\sqrt{5.8} \approx 0.38$。下列说法正确的是( )
,$K_{a}=5.8×10^{-10}$,②$\lg\sqrt{5.8} \approx 0.38$。下列说法正确的是( )
A. 硼砂稀溶液中$c(Na^{+})=c[B(OH)_{3}]$
B. 硼酸水溶液中的$H^{+}$主要来自水的电离
C. $25^{\circ}C$时,$0.01\ mol·L^{-1}$硼酸水溶液的$pH \approx 6.38$
D. 等浓度等体积的$B(OH)_{3}$和$Na[B(OH)_{4}]$溶液混合后,溶液显酸性
已知:①$25^{\circ}C$时,硼酸显酸性的原理$B(OH)_{3}+2H_{2}O \rightleftharpoons H_{3}O^{+}+$
 ,$K_{a}=5.8×10^{-10}$,②$\lg\sqrt{5.8} \approx 0.38$。下列说法正确的是( )
,$K_{a}=5.8×10^{-10}$,②$\lg\sqrt{5.8} \approx 0.38$。下列说法正确的是( )A. 硼砂稀溶液中$c(Na^{+})=c[B(OH)_{3}]$
B. 硼酸水溶液中的$H^{+}$主要来自水的电离
C. $25^{\circ}C$时,$0.01\ mol·L^{-1}$硼酸水溶液的$pH \approx 6.38$
D. 等浓度等体积的$B(OH)_{3}$和$Na[B(OH)_{4}]$溶液混合后,溶液显酸性
答案:
B [$Na_{2}B_{4}O_{5}(OH)_{4}\cdot 8H_{2}O$水解生成等物质的量浓度的$B(OH)_{3}$和$Na[B(OH)_{4}]$,$B(OH)_{3}$的电离常数$K_{a}[B(OH)_{3}]=5.8\times 10^{-10}$,$[B(OH)_{4}]^{-}$的水解平衡常数$K_{h}([B(OH)_{4}]^{-})=\frac{K_{w}}{K_{a}}=\frac{10^{-14}}{5.8\times 10^{-10}}=\frac{1}{5.8}\times 10^{-4}>K_{a}[B(OH)_{3}]$,$[B(OH)_{4}]^{-}$水解程度大于$B(OH)_{3}$电离程度,溶液显碱性,A、D错误;由$B(OH)_{3}+2H_{2}O\rightleftharpoons H_{3}O^{+}+ 可知,硼酸水溶液中的$H^{+}$是由水电离出来的,B正确;$25^{\circ}C$时,$B(OH)_{3}+2H_{2}O\rightleftharpoons H_{3}O^{+}+
可知,硼酸水溶液中的$H^{+}$是由水电离出来的,B正确;$25^{\circ}C$时,$B(OH)_{3}+2H_{2}O\rightleftharpoons H_{3}O^{+}+ ,$K_{a}=\frac{c(H^{+})\cdot c([B(OH)_{4}]^{-})}{c[B(OH)_{3}]} = 5.8\times 10^{-10}$,$c(H^{+})=\sqrt{5.8\times 10^{-10}\times c[B(OH)_{3}]}=\sqrt{5.8\times 10^{-12}}mol\cdot L^{-1}=\sqrt{5.8}\times 10^{-6}mol\cdot L^{-1}$,$pH\approx 6 - 0.38\approx 5.62$,C错误。]
,$K_{a}=\frac{c(H^{+})\cdot c([B(OH)_{4}]^{-})}{c[B(OH)_{3}]} = 5.8\times 10^{-10}$,$c(H^{+})=\sqrt{5.8\times 10^{-10}\times c[B(OH)_{3}]}=\sqrt{5.8\times 10^{-12}}mol\cdot L^{-1}=\sqrt{5.8}\times 10^{-6}mol\cdot L^{-1}$,$pH\approx 6 - 0.38\approx 5.62$,C错误。]
B [$Na_{2}B_{4}O_{5}(OH)_{4}\cdot 8H_{2}O$水解生成等物质的量浓度的$B(OH)_{3}$和$Na[B(OH)_{4}]$,$B(OH)_{3}$的电离常数$K_{a}[B(OH)_{3}]=5.8\times 10^{-10}$,$[B(OH)_{4}]^{-}$的水解平衡常数$K_{h}([B(OH)_{4}]^{-})=\frac{K_{w}}{K_{a}}=\frac{10^{-14}}{5.8\times 10^{-10}}=\frac{1}{5.8}\times 10^{-4}>K_{a}[B(OH)_{3}]$,$[B(OH)_{4}]^{-}$水解程度大于$B(OH)_{3}$电离程度,溶液显碱性,A、D错误;由$B(OH)_{3}+2H_{2}O\rightleftharpoons H_{3}O^{+}+
 可知,硼酸水溶液中的$H^{+}$是由水电离出来的,B正确;$25^{\circ}C$时,$B(OH)_{3}+2H_{2}O\rightleftharpoons H_{3}O^{+}+
可知,硼酸水溶液中的$H^{+}$是由水电离出来的,B正确;$25^{\circ}C$时,$B(OH)_{3}+2H_{2}O\rightleftharpoons H_{3}O^{+}+ ,$K_{a}=\frac{c(H^{+})\cdot c([B(OH)_{4}]^{-})}{c[B(OH)_{3}]} = 5.8\times 10^{-10}$,$c(H^{+})=\sqrt{5.8\times 10^{-10}\times c[B(OH)_{3}]}=\sqrt{5.8\times 10^{-12}}mol\cdot L^{-1}=\sqrt{5.8}\times 10^{-6}mol\cdot L^{-1}$,$pH\approx 6 - 0.38\approx 5.62$,C错误。]
,$K_{a}=\frac{c(H^{+})\cdot c([B(OH)_{4}]^{-})}{c[B(OH)_{3}]} = 5.8\times 10^{-10}$,$c(H^{+})=\sqrt{5.8\times 10^{-10}\times c[B(OH)_{3}]}=\sqrt{5.8\times 10^{-12}}mol\cdot L^{-1}=\sqrt{5.8}\times 10^{-6}mol\cdot L^{-1}$,$pH\approx 6 - 0.38\approx 5.62$,C错误。] 2.(2022·全国乙卷,13)常温下,一元酸$HA$的$K_{a}(HA)=1.0×10^{-3}$。在某体系中,$H^{+}$与$A^{-}$不能穿过隔膜,未电离的$HA$可自由穿过该膜(如图所示)。
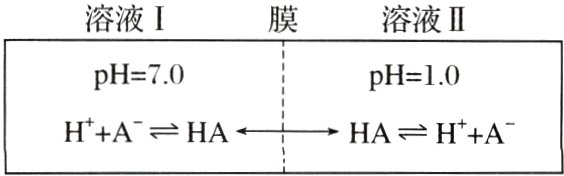
设溶液中$c_{总}(HA)=c(HA)+c(A^{-})$,当达到平衡时,下列叙述正确的是( )
A. 溶液Ⅰ中$c(H^{+})=c(OH^{-})+c(A^{-})$
B. 溶液Ⅱ中的$HA$的电离度$[\frac{c(A^{-})}{c_{总}(HA)}]$为$\frac{1}{101}$
C. 溶液Ⅰ和Ⅱ中的$c(HA)$不相等
D. 溶液Ⅰ和Ⅱ中的$c_{总}(HA)$之比为$10^{-4}$

设溶液中$c_{总}(HA)=c(HA)+c(A^{-})$,当达到平衡时,下列叙述正确的是( )
A. 溶液Ⅰ中$c(H^{+})=c(OH^{-})+c(A^{-})$
B. 溶液Ⅱ中的$HA$的电离度$[\frac{c(A^{-})}{c_{总}(HA)}]$为$\frac{1}{101}$
C. 溶液Ⅰ和Ⅱ中的$c(HA)$不相等
D. 溶液Ⅰ和Ⅱ中的$c_{总}(HA)$之比为$10^{-4}$
答案:
B [常温下,溶液Ⅰ的$pH = 7.0$,则溶液Ⅰ中$c(H^{+}) = c(OH^{-}) = 1\times 10^{-7}mol\cdot L^{-1}$,$c(H^{+})<c(OH^{-}) + c(A^{-})$,A错误;常温下,溶液Ⅱ的$pH = 1.0$,溶液中$c(H^{+}) = 0.1mol\cdot L^{-1}$,$K_{a}(HA)=\frac{c(H^{+})\cdot c(A^{-})}{c(HA)} = 1.0\times 10^{-3}$,$c_{总}(HA)=c(HA)+c(A^{-})$,则$\frac{0.1c(A^{-})}{c_{总}(HA)-c(A^{-})}=1.0\times 10^{-3}$,解得$\frac{c(A^{-})}{c_{总}(HA)}=\frac{1}{101}$,B正确;根据题意,未电离的HA可自由穿过隔膜,故溶液Ⅰ和Ⅱ中的$c(HA)$相等,C错误;常温下,溶液Ⅰ的$pH = 7.0$,溶液Ⅰ中$c(H^{+}) = 1\times 10^{-7}mol\cdot L^{-1}$,$K_{a}(HA)=\frac{c(H^{+})\cdot c(A^{-})}{c(HA)} = 1.0\times 10^{-3}$,$c_{总}(HA)=c(HA)+c(A^{-})$,$\frac{10^{-7}[c_{总}(HA)-c(HA)]}{c(HA)} = 1.0\times 10^{-3}$,溶液Ⅰ中$c_{总}(HA)=(10^{4}+1)c(HA)$;溶液Ⅱ中,由B项解析可知$c_{总}(HA)=1.01c(HA)$,未电离的HA可自由穿过隔膜,故溶液Ⅰ和Ⅱ中的$c(HA)$相等,溶液Ⅰ和Ⅱ中$c_{总}(HA)$之比为$[(10^{4}+1)c(HA)]:[1.01c(HA)]=(10^{4}+1):1.01\approx 10^{4}$,D错误。]
查看更多完整答案,请扫码查看


