第58页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
5.(2023·湖北,14)$H_{2}L$为某邻苯二酚类配体,其$pK_{a1}=7.46$,$pK_{a2}=12.4$。常温下构建$Fe(Ⅲ)-H_{2}L$溶液体系,其中$c_{0}(Fe^{3 + })=2.0\times10^{-4}\ mol\cdot L^{-1}$,$c_{0}(H_{2}L)=5.0\times10^{-3}\ mol\cdot L^{-1}$。体系中含Fe物种的组分分布系数$\delta$与pH的关系如图所示,分布系数$\delta(x)=\frac{c(x)}{2.0\times10^{-4}\ mol\cdot L^{-1}}$,已知$lg\ 2\approx0.30$,$lg\ 3\approx0.48$。下列说法正确的是 ( )

Fe(III)−$H_{2}L$体系部分物种分布图
A.当$pH = 1$时,体系中$c(H_{2}L)>c([FeL]^{+})>c(OH^{-})>c(HL^{-})$
B.pH在9.5~10.5之间,含L的物种主要为$L^{2 - }$
C.$L^{2 - }+[FeL]^{+}\rightleftharpoons[FeL_{2}]^{-}$的平衡常数的$lg\ K$约为14
D.当$pH = 10$时,参与配位的$c(L^{2 - })\approx1.0\times10^{-3}\ mol\cdot L^{-1}$

Fe(III)−$H_{2}L$体系部分物种分布图
A.当$pH = 1$时,体系中$c(H_{2}L)>c([FeL]^{+})>c(OH^{-})>c(HL^{-})$
B.pH在9.5~10.5之间,含L的物种主要为$L^{2 - }$
C.$L^{2 - }+[FeL]^{+}\rightleftharpoons[FeL_{2}]^{-}$的平衡常数的$lg\ K$约为14
D.当$pH = 10$时,参与配位的$c(L^{2 - })\approx1.0\times10^{-3}\ mol\cdot L^{-1}$
答案:
C [由图可知,$pH = 1$,即$c(H^{+}) = 0.1mol\cdot L^{-1}$时$c([FeL]^{+}) = 1.0\times10^{-4}mol\cdot L^{-1}$,又$c_{0}(H_{2}L)=5.0\times10^{-3}mol\cdot L^{-1}$,根据$Fe^{3 + }+H_{2}L\rightleftharpoons[FeL]^{+}+2H^{+}$知,此时$c(H_{2}L)=(5.0 - 0.1)\times10^{-3}mol\cdot L^{-1}=4.9\times10^{-3}mol\cdot L^{-1}$,结合$K_{a1}=\frac{c(H^{+})\cdot c(HL^{-})}{c(H_{2}L)} = 10^{-7.46}$知,此时$c(HL^{-}) = 10^{-7.46}\times4.9\times10^{-3}\times10 = 4.9\times10^{-9.46}mol\cdot L^{-1}$,又$pH = 1$时,$c(OH^{-}) = 10^{-13}mol\cdot L^{-1}$,故A错误;$pH$在$9.5\sim10.5$之间时$c([FeL_{3}]^{3 - })=c([FeL_{2}(OH)]^{2 - })=10^{-4}mol\cdot L^{-1}$,其中两种离子共含$c(L^{2 - })=3\times10^{-4}mol\cdot L^{-1}+2\times10^{-4}mol\cdot L^{-1}=5\times10^{-4}mol\cdot L^{-1}$,当$pH = 10$时,$c(H^{+}) = 10^{-10}mol\cdot L^{-1}$,根据$K_{a1}=\frac{c(H^{+})\cdot c(HL^{-})}{c(H_{2}L)}=\frac{10^{-10}c(HL^{-})}{c(H_{2}L)} = 10^{-7.46}$,$c(HL^{-}) = 10^{2.54}c(H_{2}L)$,即$c(HL^{-})>c(H_{2}L)$,由$K_{a2}=\frac{c(H^{+})\cdot c(L^{2 - })}{c(HL^{-})}=10^{-12.4}$,得$c(HL^{-}) = 10^{2.1}c(L^{2 - })$,即$c(HL^{-})>c(L^{2 - })$,B、D错误;该反应的平衡常数$K=\frac{c([FeL_{2}]^{-})}{c(L^{2 - })\cdot c([FeL]^{+})}$,由题图知,当$c([FeL_{2}]^{-}) = c([FeL]^{+})$时,$pH = 4$,由$K_{a1}\cdot K_{a2}=10^{-19.86}=\frac{c^{2}(H^{+})\cdot c(L^{2 - })}{c(H_{2}L)}$,得①式:$10^{-19.86}\times c(H_{2}L)=10^{-8}c(L^{2 - })$,此时$c(H_{2}L)=5.0\times10^{-3}mol\cdot L^{-1}-3\times10^{-4}mol\cdot L^{-1}=4.7\times10^{-3}mol\cdot L^{-1}$,代入①式,$c(L^{2 - })=\frac{4.7\times10^{-22.86}}{10^{-8}} = 4.7\times10^{-14.86}mol\cdot L^{-1}$,则$K=\frac{1}{4.7\times10^{-14.86}}\approx2.1\times10^{13.86}$,故$lgK = 13.86+lg2.1\approx14$,C正确。]
6.(2017·全国卷Ⅰ,13)常温下将NaOH溶液滴加到己二酸($H_{2}X$)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是 ( )
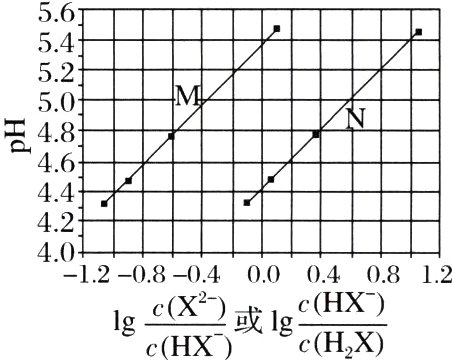
A.$K_{a2}(H_{2}X)$的数量级为$10^{-6}$
B.曲线N表示pH与$lg\frac{c(HX^{-})}{c(H_{2}X)}$的变化关系
C.$NaHX$溶液中$c(H^{+})>c(OH^{-})$
D.当混合溶液呈中性时,$c(Na^{+})>c(HX^{-})>c(X^{2 - })>c(OH^{-})=c(H^{+})$

A.$K_{a2}(H_{2}X)$的数量级为$10^{-6}$
B.曲线N表示pH与$lg\frac{c(HX^{-})}{c(H_{2}X)}$的变化关系
C.$NaHX$溶液中$c(H^{+})>c(OH^{-})$
D.当混合溶液呈中性时,$c(Na^{+})>c(HX^{-})>c(X^{2 - })>c(OH^{-})=c(H^{+})$
答案:
D [横坐标取0时,曲线M对应$pH$约为$5.4$,曲线N对应$pH$约为$4.4$,因为是$NaOH$滴定$H_{2}X$溶液,所以在酸性较强的溶液中会存在$c(HX^{-}) = c(H_{2}X)$,所以曲线N表示$pH$与$lg\frac{c(HX^{-})}{c(H_{2}X)}$的变化关系,B正确;$\frac{c(HX^{-})}{c(H_{2}X)} = 1$时,即$lg\frac{c(HX^{-})}{c(H_{2}X)} = 0$,$pH\approx5.4$,$c(H^{+}) = 1\times10^{-5.4}mol\cdot L^{-1}$,$K_{a2}(H_{2}X)=\frac{c(H^{+})\cdot c(X^{2 - })}{c(HX^{-})}=1\times10^{-5.4}$,A正确;由图像可知,当$lg\frac{c(HX^{-})}{c(H_{2}X)} = 0$时,$pH\approx4.4$,则$K_{a1}(H_{2}X)=10^{-4.4}$,$NaHX$溶液中,$HX^{-}$的电离常数$K_{a2}(H_{2}X)$大于其水解常数$[\frac{K_{w}}{K_{a1}(H_{2}X)}]$,此时溶液呈酸性,C正确;当溶液呈中性时,由曲线M可知$lg\frac{c(X^{2 - })}{c(HX^{-})}>0$,$\frac{c(X^{2 - })}{c(HX^{-})}>1$,即$c(X^{2 - })>c(HX^{-})$,D错误。]
7.(2021·辽宁,15)用$0.100\ 0\ mol\cdot L^{-1}$盐酸滴定20.00 mL$Na_{2}A$溶液,溶液中$H_{2}A$、$HA^{-}$、$A^{2 - }$的分布分数$\delta$随pH变化曲线及滴定曲线如图。下列说法正确的是[如$A^{2 - }$分布分数:$\delta(A^{2 - })=\frac{c(A^{2 - })}{c(H_{2}A)+c(HA^{-})+c(A^{2 - })}$] ( )

A.$H_{2}A$的$K_{a1}$为$10^{-10.25}$
B.c点:$c(HA^{-})>c(A^{2 - })>c(H_{2}A)$
C.第一次突变,可选酚酞作指示剂
D.$c(Na_{2}A)=0.200\ 0\ mol\cdot L^{-1}$

A.$H_{2}A$的$K_{a1}$为$10^{-10.25}$
B.c点:$c(HA^{-})>c(A^{2 - })>c(H_{2}A)$
C.第一次突变,可选酚酞作指示剂
D.$c(Na_{2}A)=0.200\ 0\ mol\cdot L^{-1}$
答案:
C

$[H_{2}A$的$K_{a1}=\frac{c(H^{+})\cdot c(HA^{-})}{c(H_{2}A)}$,根据上图交点1计算可知$K_{a1}=10^{-5.38}$,A错误;根据图像可知c点$c(HA^{-})>c(H_{2}A)>c(A^{2 - })$,B错误;根据图像可知第一次滴定突变溶液呈碱性,所以可以选择酚酞作指示剂,C正确;根据图像e点可知,当加入盐酸$40mL$时,全部生成$H_{2}A$,根据$Na_{2}A + 2HCl=2NaCl + H_{2}A$计算可知$c(Na_{2}A)=0.1000mol\cdot L^{-1}$,D错误。]
C

$[H_{2}A$的$K_{a1}=\frac{c(H^{+})\cdot c(HA^{-})}{c(H_{2}A)}$,根据上图交点1计算可知$K_{a1}=10^{-5.38}$,A错误;根据图像可知c点$c(HA^{-})>c(H_{2}A)>c(A^{2 - })$,B错误;根据图像可知第一次滴定突变溶液呈碱性,所以可以选择酚酞作指示剂,C正确;根据图像e点可知,当加入盐酸$40mL$时,全部生成$H_{2}A$,根据$Na_{2}A + 2HCl=2NaCl + H_{2}A$计算可知$c(Na_{2}A)=0.1000mol\cdot L^{-1}$,D错误。]
查看更多完整答案,请扫码查看


