第35页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
1. (2024·湖北,14)我国科学家设计了一种双位点$PbCu$电催化剂,用$H_{2}C_{2}O_{4}$和$NH_{2}OH$电化学催化合成甘氨酸,原理如图,双极膜中$H_{2}O$解离的$H^{+}$和$OH^{-}$在电场作用下向两极迁移。已知在$KOH$溶液中,甲醛转化为$HOCH_{2}O^{-}$,存在平衡$HOCH_{2}O^{-}+OH^{-}\rightleftharpoons [OCH_{2}O]^{2 - }+H_{2}O$。$Cu$电极上发生的电子转移反应为$[OCH_{2}O]^{2 - } - e^{-}=HCOO^{-}+H\cdot$。下列说法错误的是( )

A. 电解一段时间后阳极区$c(OH^{-})$减小
B. 理论上生成$1\ mol\ H_{3}N^{+}CH_{2}COOH$双极膜中有$4\ mol\ H_{2}O$解离
C. 阳极总反应式为$2HCHO + 4OH^{-}-2e^{-}=2HCOO^{-}+H_{2}\uparrow + 2H_{2}O$
D. 阴极区存在反应$H_{2}C_{2}O_{4}+2H^{+}+2e^{-}=OHCCOOH + H_{2}O$

A. 电解一段时间后阳极区$c(OH^{-})$减小
B. 理论上生成$1\ mol\ H_{3}N^{+}CH_{2}COOH$双极膜中有$4\ mol\ H_{2}O$解离
C. 阳极总反应式为$2HCHO + 4OH^{-}-2e^{-}=2HCOO^{-}+H_{2}\uparrow + 2H_{2}O$
D. 阴极区存在反应$H_{2}C_{2}O_{4}+2H^{+}+2e^{-}=OHCCOOH + H_{2}O$
答案:
B [由题意可知,Cu电极为阳极,电极总反应为$2HCHO - 2e^{-}+4OH^{-}=2HCOO^{-}+H_{2}\uparrow +2H_{2}O$,阳极区消耗$OH^{-}$、同时生成$H_{2}O$,$c(OH^{-})$减小,A、C正确;PbCu电极为阴极,首先$HOOC - COOH$在Pb上发生得电子的还原反应转化为$OHC - COOH:H_{2}C_{2}O_{4}+2e^{-}+2H^{+}=OHC - COOH + H_{2}O$,$OHC - COOH$与$HO - N^{+}H_{3}$反应生成$HOOC - CH = N - OH:OHC - COOH + HO - N^{+}H_{3}=HOOC - CH = N - OH + H_{2}O + H^{+}$,$HOOC - CH = N - OH$发生得电子的还原反应转化成$H_{3}N^{+}CH_{2}COOH:HOOC - CH = N - OH + 4e^{-}+5H^{+}=H_{3}N^{+}CH_{2}COOH + H_{2}O$,阴极总反应为$H_{2}C_{2}O_{4}+NH_{2}OH + 6e^{-}+7H^{+}=H_{3}N^{+}CH_{2}COOH + 3H_{2}O$,1mol$H_{2}O$解离成1mol$H^{+}$和1mol$OH^{-}$,故理论上生成1mol$H_{3}N^{+}CH_{2}COOH$双极膜中有6mol$H_{2}O$解离,B错误、D正确。]
2. (2024·黑吉辽,12)“绿色零碳”氢能前景广阔。为解决传统电解水制“绿氢”阳极电势高、反应速率缓慢的问题,科技工作者设计耦合$HCHO$高效制$H_{2}$的方法,装置如图所示。部分反应机理为${HCHO + OH^{-}\rightleftharpoons HOCH_{2}O^{-}\rightleftharpoons [OCH_{2}O]^{2 - } + H_{2}O}$,$[OCH_{2}O]^{2 - } - e^{-}=HCOO^{-}+H\cdot$。下列说法错误的是( )

A. 相同电量下$H_{2}$理论产量是传统电解水的$1.5$倍
B. 阴极反应:$2H_{2}O + 2e^{-}=2OH^{-}+H_{2}\uparrow$
C. 电解时$OH^{-}$通过阴离子交换膜向$b$极方向移动
D. 阳极反应:$2HCHO - 2e^{-}+4OH^{-}=2HCOO^{-}+2H_{2}O + H_{2}\uparrow$

A. 相同电量下$H_{2}$理论产量是传统电解水的$1.5$倍
B. 阴极反应:$2H_{2}O + 2e^{-}=2OH^{-}+H_{2}\uparrow$
C. 电解时$OH^{-}$通过阴离子交换膜向$b$极方向移动
D. 阳极反应:$2HCHO - 2e^{-}+4OH^{-}=2HCOO^{-}+2H_{2}O + H_{2}\uparrow$
答案:
A [据图示可知,b电极上HCHO转化为$HCOO^{-}$,HCHO发生氧化反应,所以b电极为阳极,a电极为阴极,HCHO为阳极反应物,阳极反应:①$HCHO + OH^{-}-e^{-}=HCOOH+\frac{1}{2}H_{2}\uparrow$,②$HCOOH + OH^{-}=HCOO^{-}+H_{2}O$,阴极反应:$2H_{2}O + 2e^{-}=H_{2}\uparrow + 2OH^{-}$,即转移2mol电子时,阴、阳两极各生成1mol$H_{2}$,共2mol$H_{2}$;而传统电解水:$2H_{2}O\xlongequal{电解}2H_{2}\uparrow + O_{2}\uparrow$,转移2mol电子,只有阴极生成1mol$H_{2}$,所以相同电量下$H_{2}$理论产量是传统电解水的2倍,故A错误、B正确;由电极反应式可知,电解过程中阴极生成$OH^{-}$,$OH^{-}$通过阴离子交换膜向阳极移动,即向b极方向移动,故C正确;由分析可知阳极反应为$2HCHO - 2e^{-}+4OH^{-}=2HCOO^{-}+2H_{2}O + H_{2}\uparrow$,故D正确。]
3. (2023·湖北,10)我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无$Cl_{2}$生成且$KOH$溶液的浓度不变,电解生成氢气的速率为$x\ mol\cdot h^{-1}$。下列说法错误的是( )
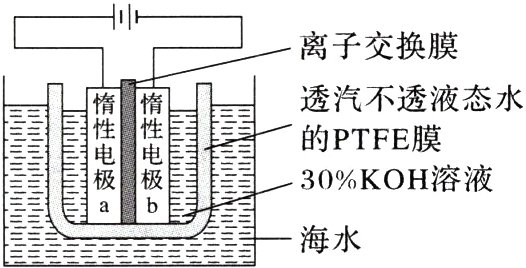
A. $b$电极反应式为$2H_{2}O + 2e^{-}=H_{2}\uparrow + 2OH^{-}$
B. 离子交换膜为阴离子交换膜
C. 电解时海水中动能高的水分子可穿过$PTFE$膜
D. 海水为电解池补水的速率为$2x\ mol\cdot h^{-1}$

A. $b$电极反应式为$2H_{2}O + 2e^{-}=H_{2}\uparrow + 2OH^{-}$
B. 离子交换膜为阴离子交换膜
C. 电解时海水中动能高的水分子可穿过$PTFE$膜
D. 海水为电解池补水的速率为$2x\ mol\cdot h^{-1}$
答案:
3.D [b电极为阴极,发生还原反应,电极反应为$2H_{2}O + 2e^{-}=H_{2}\uparrow + 2OH^{-}$,故A正确;该装置工作时阳极无$Cl_{2}$生成且KOH浓度不变,阳极发生的电极反应为$4OH^{-}-4e^{-}=O_{2}\uparrow + 2H_{2}O$,为保持$OH^{-}$浓度不变,则阴极产生的$OH^{-}$要通过离子交换膜进入阳极室,即离子交换膜应为阴离子交换膜,故B正确;电解时电解槽中不断有水被消耗,海水中动能高的水以“汽”的形式穿过PTFE膜,为电解池补水,故C正确;由电解总反应可知,每生成1mol$H_{2}$要消耗1mol$H_{2}O$,生成$H_{2}$的速率为$x\ mol\cdot h^{-1}$,则补水的速率也应是$x\ mol\cdot h^{-1}$,故D错误。]
4. (2022·全国甲卷,10)一种水性电解液$Zn - MnO_{2}$离子选择双隔膜电池如图所示$[KOH$溶液中,$Zn^{2 + }$以$Zn(OH)_{4}^{2 - }$存在$]$。电池放电时,下列叙述错误的是( )

A. Ⅱ区的$K^{+}$通过隔膜向Ⅲ区迁移
B. Ⅰ区的$SO_{4}^{2 - }$通过隔膜向Ⅱ区迁移
C. $MnO_{2}$电极反应:$MnO_{2}+2e^{-}+4H^{+}=Mn^{2 + }+2H_{2}O$
D. 电池总反应:$Zn + 4OH^{-}+MnO_{2}+4H^{+}=Zn(OH)_{4}^{2 - }+Mn^{2 + }+2H_{2}O$

A. Ⅱ区的$K^{+}$通过隔膜向Ⅲ区迁移
B. Ⅰ区的$SO_{4}^{2 - }$通过隔膜向Ⅱ区迁移
C. $MnO_{2}$电极反应:$MnO_{2}+2e^{-}+4H^{+}=Mn^{2 + }+2H_{2}O$
D. 电池总反应:$Zn + 4OH^{-}+MnO_{2}+4H^{+}=Zn(OH)_{4}^{2 - }+Mn^{2 + }+2H_{2}O$
答案:
4.A [根据图示的电池结构和题目所给信息可知,Ⅲ区Zn为电池的负极,电极反应为$Zn - 2e^{-}+4OH^{-}=Zn(OH)_{4}^{2 - }$,Ⅰ区$MnO_{2}$为电池的正极,电极反应为$MnO_{2}+2e^{-}+4H^{+}=Mn^{2 + }+2H_{2}O$,$K^{+}$从Ⅲ区通过隔膜向Ⅱ区迁移,A错误、C正确;Ⅰ区的$SO_{4}^{2 - }$通过隔膜向Ⅲ区迁移,B正确;电池的总反应为$Zn + 4OH^{-}+MnO_{2}+4H^{+}=Zn(OH)_{4}^{2 - }+Mn^{2 + }+2H_{2}O$,D正确。]
查看更多完整答案,请扫码查看


