第45页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
1. [2024·安徽,17(1)]$C_{2}H_{6}$氧化脱氢反应:
$2C_{2}H_{6}(g)+O_{2}(g)=2C_{2}H_{4}(g)+2H_{2}O(g)$ $\Delta H_{1}=-209.8\ kJ\cdot mol^{-1}$
$C_{2}H_{6}(g)+CO_{2}(g)=C_{2}H_{4}(g)+H_{2}O(g)+CO(g)$ $\Delta H_{2}=+178.1\ kJ\cdot mol^{-1}$
计算:$2CO(g)+O_{2}(g)=2CO_{2}(g)$ $\Delta H_{3}=$__________$kJ\cdot mol^{-1}$。
$2C_{2}H_{6}(g)+O_{2}(g)=2C_{2}H_{4}(g)+2H_{2}O(g)$ $\Delta H_{1}=-209.8\ kJ\cdot mol^{-1}$
$C_{2}H_{6}(g)+CO_{2}(g)=C_{2}H_{4}(g)+H_{2}O(g)+CO(g)$ $\Delta H_{2}=+178.1\ kJ\cdot mol^{-1}$
计算:$2CO(g)+O_{2}(g)=2CO_{2}(g)$ $\Delta H_{3}=$__________$kJ\cdot mol^{-1}$。
答案:
-566
解析 将两个反应依次标号为反应①和反应②,反应① - 反应②×2 可得目标反应,根据盖斯定律知 $\Delta H_{3}=\Delta H_{1}-2\Delta H_{2}=(-209.8\ kJ\cdot mol^{-1}-178.1\ kJ\cdot mol^{-1}\times 2)=-566\ kJ\cdot mol^{-1}$。
解析 将两个反应依次标号为反应①和反应②,反应① - 反应②×2 可得目标反应,根据盖斯定律知 $\Delta H_{3}=\Delta H_{1}-2\Delta H_{2}=(-209.8\ kJ\cdot mol^{-1}-178.1\ kJ\cdot mol^{-1}\times 2)=-566\ kJ\cdot mol^{-1}$。
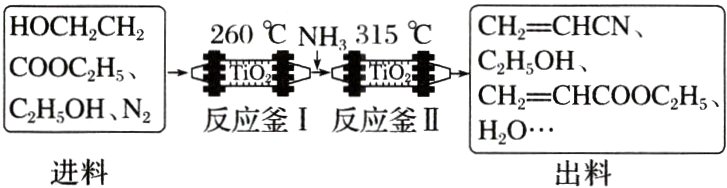
2. [2024·湖南,18(1)]丙烯腈$(CH_{2}=CHCN)$是一种重要的化工原料。工业上以$N_{2}$为载气,用$TiO_{2}$作催化剂生产$CH_{2}=CHCN$的流程如下:
$\begin{array}{|c|c|c|}\hline HOCH_{2}CH_{2}COOC_{2}H_{5}、C_{2}H_{5}OH、N_{2}&\xrightarrow[TiO_{2}]{260^{\circ}C}&CH_{2}=CHCOOC_{2}H_{5}、H_{2}O\\进料&&\downarrow TiO_{2},315^{\circ}C\\&&CH_{2}=CHCN、C_{2}H_{5}OH、CH_{2}=CHCOOC_{2}H_{5}、H_{2}O...\\&&出料\\\hline\end{array}$
已知:①进料混合气进入两釜的流量恒定,两釜中反应温度恒定;
②反应釜I中发生的反应:
i:$HOCH_{2}CH_{2}COOC_{2}H_{5}(g)=CH_{2}=CHCOOC_{2}H_{5}(g)+H_{2}O(g)$ $\Delta H_{1}$
③反应釜II中发生的反应:
ii:$CH_{2}=CHCOOC_{2}H_{5}(g)+NH_{3}(g)=CH_{2}=CHCONH_{2}(g)+C_{2}H_{5}OH(g)$ $\Delta H_{2}$
iii:$CH_{2}=CHCONH_{2}(g)=CH_{2}=CHCN(g)+H_{2}O(g)$ $\Delta H_{3}$
④在此生产条件下,酯类物质可能发生水解。
总反应$HOCH_{2}CH_{2}COOC_{2}H_{5}(g)+NH_{3}(g)=CH_{2}=CHCN(g)+C_{2}H_{5}OH(g)+2H_{2}O(g)$ $\Delta H=$____________(用含$\Delta H_{1}$、$\Delta H_{2}$、和$\Delta H_{3}$的代数式表示)。
$\begin{array}{|c|c|c|}\hline HOCH_{2}CH_{2}COOC_{2}H_{5}、C_{2}H_{5}OH、N_{2}&\xrightarrow[TiO_{2}]{260^{\circ}C}&CH_{2}=CHCOOC_{2}H_{5}、H_{2}O\\进料&&\downarrow TiO_{2},315^{\circ}C\\&&CH_{2}=CHCN、C_{2}H_{5}OH、CH_{2}=CHCOOC_{2}H_{5}、H_{2}O...\\&&出料\\\hline\end{array}$
已知:①进料混合气进入两釜的流量恒定,两釜中反应温度恒定;
②反应釜I中发生的反应:
i:$HOCH_{2}CH_{2}COOC_{2}H_{5}(g)=CH_{2}=CHCOOC_{2}H_{5}(g)+H_{2}O(g)$ $\Delta H_{1}$
③反应釜II中发生的反应:
ii:$CH_{2}=CHCOOC_{2}H_{5}(g)+NH_{3}(g)=CH_{2}=CHCONH_{2}(g)+C_{2}H_{5}OH(g)$ $\Delta H_{2}$
iii:$CH_{2}=CHCONH_{2}(g)=CH_{2}=CHCN(g)+H_{2}O(g)$ $\Delta H_{3}$
④在此生产条件下,酯类物质可能发生水解。
总反应$HOCH_{2}CH_{2}COOC_{2}H_{5}(g)+NH_{3}(g)=CH_{2}=CHCN(g)+C_{2}H_{5}OH(g)+2H_{2}O(g)$ $\Delta H=$____________(用含$\Delta H_{1}$、$\Delta H_{2}$、和$\Delta H_{3}$的代数式表示)。

答案:
$\Delta H_{1}+\Delta H_{2}+\Delta H_{3}$
解析 根据盖斯定律,由反应ⅰ + 反应ⅱ + 反应ⅲ得 $HOCH_{2}CH_{2}COOC_{2}H_{5}(g)+NH_{3}(g)\longrightarrow CH_{2}=CHCN(g)+C_{2}H_{5}OH(g)+2H_{2}O(g)$,故 $\Delta H = \Delta H_{1}+\Delta H_{2}+\Delta H_{3}$。
解析 根据盖斯定律,由反应ⅰ + 反应ⅱ + 反应ⅲ得 $HOCH_{2}CH_{2}COOC_{2}H_{5}(g)+NH_{3}(g)\longrightarrow CH_{2}=CHCN(g)+C_{2}H_{5}OH(g)+2H_{2}O(g)$,故 $\Delta H = \Delta H_{1}+\Delta H_{2}+\Delta H_{3}$。
3. [2024·河北,17(1)①]硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下:
$SO_{2}(g)+Cl_{2}(g)\rightleftharpoons SO_{2}Cl_{2}(g)$
$\Delta H=-67.59\ kJ\cdot mol^{-1}$。
若正反应的活化能为$E_{正}\ kJ\cdot mol^{-1}$,则逆反应的活化能$E_{逆}=$__________$kJ\cdot mol^{-1}$(用含$E_{正}$的代数式表示)。
$SO_{2}(g)+Cl_{2}(g)\rightleftharpoons SO_{2}Cl_{2}(g)$
$\Delta H=-67.59\ kJ\cdot mol^{-1}$。
若正反应的活化能为$E_{正}\ kJ\cdot mol^{-1}$,则逆反应的活化能$E_{逆}=$__________$kJ\cdot mol^{-1}$(用含$E_{正}$的代数式表示)。
答案:
$E_{正}+67.59$
解析 根据反应热与活化能 $E_{正}$ 和 $E_{逆}$ 关系 $\Delta H = E_{正}-E_{逆}$ 可知,该反应的 $E_{逆}=[E_{正}-(-67.59)]kJ\cdot mol^{-1}=(E_{正}+67.59)kJ\cdot mol^{-1}$。
解析 根据反应热与活化能 $E_{正}$ 和 $E_{逆}$ 关系 $\Delta H = E_{正}-E_{逆}$ 可知,该反应的 $E_{逆}=[E_{正}-(-67.59)]kJ\cdot mol^{-1}=(E_{正}+67.59)kJ\cdot mol^{-1}$。
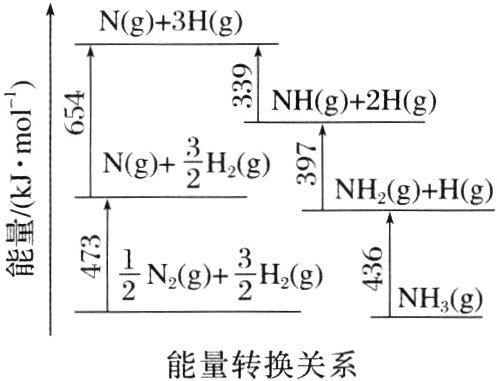
4. [2023·新课标卷,29(1)]根据图示数据计算反应$\frac{1}{2}N_{2}(g)+\frac{3}{2}H_{2}(g)=NH_{3}(g)$的$\Delta H=$__________$kJ\cdot mol^{-1}$。

答案:
-45
解析 在化学反应中,断开化学键要消耗能量,形成化学键要释放能量,反应的焓变等于反应物的键能总和与生成物的键能总和的差,因此,由图中数据可知,反应 $\frac{1}{2}N_{2}(g)+\frac{3}{2}H_{2}(g)\xlongequal{\;\;}NH_{3}(g)$ 的 $\Delta H=(473 + 654 - 436 - 397 - 339)kJ\cdot mol^{-1}=-45\ kJ\cdot mol^{-1}$。
解析 在化学反应中,断开化学键要消耗能量,形成化学键要释放能量,反应的焓变等于反应物的键能总和与生成物的键能总和的差,因此,由图中数据可知,反应 $\frac{1}{2}N_{2}(g)+\frac{3}{2}H_{2}(g)\xlongequal{\;\;}NH_{3}(g)$ 的 $\Delta H=(473 + 654 - 436 - 397 - 339)kJ\cdot mol^{-1}=-45\ kJ\cdot mol^{-1}$。
查看更多完整答案,请扫码查看


