第23页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
9.(2024·湖南,9)通过理论计算方法优化了P和Q的分子结构,P和Q呈平面六元并环结构,原子的连接方式如图所示,下列说法错误的是 ( )
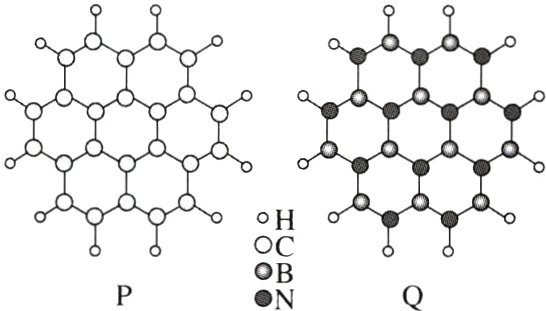
A. P为非极性分子,Q为极性分子
B. 第一电离能:B<C<N
C. 1 mol P和1 mol Q所含电子数目相等
D. P和Q分子中C、B和N均为$sp^{2}$杂化

A. P为非极性分子,Q为极性分子
B. 第一电离能:B<C<N
C. 1 mol P和1 mol Q所含电子数目相等
D. P和Q分子中C、B和N均为$sp^{2}$杂化
答案:
9.A [由题给分子结构知,P 和 Q 分子都满足对称,正、负电中心均重合,都是非极性分子,A 错误;同周期从左到右,元素的第一电离能呈增大趋势,氮原子的 2p 轨道为稳定的半充满结构,第一电离能大于相邻元素,则第一电离能由小到大的顺序为 B<C<N,故 B 正确;P 的分子式为$C_{24}H_{12}$,Q 的分子式为$B_{12}N_{12}H_{12}$,P、Q 分子都含 156 个电子,1 mol P 和 1 mol Q 所含电子数目相等,C 正确;P 和 Q 分子中 C、B 和 N 均与其他三个原子成键,P 和 Q 分子呈平面结构,故 P 和 Q 分子中 C、B 和 N 均为$sp^{2}$杂化,D 正确。]
10.(2024·安徽,8)某催化剂结构简式如图所示。下列说法错误的是 ( )

A. 该物质中Ni为 + 2价
B. 基态原子的第一电离能:Cl>P
C. 该物质中C和P均采取$sp^{2}$杂化
D. 基态Ni原子价电子排布式为$3d^{8}4s^{2}$

A. 该物质中Ni为 + 2价
B. 基态原子的第一电离能:Cl>P
C. 该物质中C和P均采取$sp^{2}$杂化
D. 基态Ni原子价电子排布式为$3d^{8}4s^{2}$
答案:
10.C [由结构简式可知,P 原子的 3 个单电子与苯环形成共用电子对,P 原子剩余的孤电子对与 Ni 形成配位键,$Cl^{-}$提供孤电子对与 Ni 形成共价键,由于整个分子呈电中性,故该物质中 Ni 为 + 2 价,A 项正确;同周期元素随着原子序数的增大,第一电离能有增大趋势,故基态原子的第一电离能:Cl>P,B 项正确;C 均存在于苯环上,采取$sp^{2}$杂化,P 价层电子对数为 4,采取$sp^{3}$杂化,C 项错误;Ni 的原子序数为 28,位于第四周期第Ⅷ族,基态 Ni 原子价电子排布式为$3d^{8}4s^{2}$,D 项正确。]
11.(2023·湖北,11)物质结构决定物质性质。下列性质差异与结构因素匹配错误的是 ( )

|选项|性质差异|结构因素|
| ---- | ---- | ---- |
|A|沸点:正戊烷(36.1℃)高于新戊烷(9.5℃)|分子间作用力|
|B|熔点:$AlF_{3}$(1 040℃)远高于$AlCl_{3}$(178℃升华)|晶体类型|
|C|酸性:$CF_{3}COOH$($pK_{a}=0.23$),远强于$CH_{3}COOH$($pK_{a}=4.76$)|羟基极性|
|D|溶解度(20℃):$Na_{2}CO_{3}$(29 g)大于$NaHCO_{3}$(8 g)|阴离子电荷|

|选项|性质差异|结构因素|
| ---- | ---- | ---- |
|A|沸点:正戊烷(36.1℃)高于新戊烷(9.5℃)|分子间作用力|
|B|熔点:$AlF_{3}$(1 040℃)远高于$AlCl_{3}$(178℃升华)|晶体类型|
|C|酸性:$CF_{3}COOH$($pK_{a}=0.23$),远强于$CH_{3}COOH$($pK_{a}=4.76$)|羟基极性|
|D|溶解度(20℃):$Na_{2}CO_{3}$(29 g)大于$NaHCO_{3}$(8 g)|阴离子电荷|
答案:
11.D [由于新戊烷支链多,对称性好,分子间作用力小,所以沸点较低,故 A 正确;$AlF_{3}$为离子晶体,熔点较高,$AlCl_{3}$为分子晶体,熔点较低,则$AlF_{3}$熔点远高于$AlCl_{3}$,故 B 正确;由于电负性:F>H,C - F 键极性大于 C - H 键,使得羧基上的羟基极性增强,氢原子更容易电离,酸性增强,故 C 正确;碳酸氢钠在水中的溶解度比碳酸钠小的原因是碳酸氢钠晶体中$HCO_{3}^{-}$间存在氢键,导致其不易溶于水,与阴离子电荷无关,故 D 错误。]
12.(2022·辽宁,7)理论化学模拟得到一种$N_{13}^{+}$离子,结构如图。下列关于该离子的说法错误的是 ( )
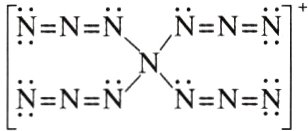
A. 所有原子均满足8电子结构
B. N原子的杂化方式有2种
C. 空间结构为四面体形
D. 常温下不稳定

A. 所有原子均满足8电子结构
B. N原子的杂化方式有2种
C. 空间结构为四面体形
D. 常温下不稳定
答案:
12.B [由$N_{5}^{+}$的结构式可知,所有 N 原子均满足 8 电子稳定结构,A 正确;中心 N 原子为$sp^{3}$杂化,与中心 N 原子直接相连的 N 原子为$sp^{2}$杂化,与端位 N 原子直接相连的 N 原子为 sp 杂化,端位 N 原子为$sp^{2}$杂化,则 N 原子的杂化方式有 3 种,B 错误;中心 N 原子为$sp^{3}$杂化,则其空间结构为四面体形,C 正确;$N_{5}^{+}$中含$-N = N - N -$,常温下不稳定,D 正确。]
1.(2024·河北,12)金属铋及其化合物广泛应用于电子设备、医药等领域。如图是铋的一种氟化物的立方晶胞及晶胞中M、N、P、Q点的截面图,晶胞的边长为a pm,$N_{\mathrm{A}}$为阿伏加德罗常数的值。下列说法错误的是( )

A. 该铋氟化物的化学式为$\mathrm{BiF}_{3}$
B. 粒子S、T之间的距离为$\frac{\sqrt{11}}{4}a$ pm
C. 该晶体的密度为$\frac{1064}{N_{\mathrm{A}}\times a^{3}\times10^{-30}}\mathrm{g}\cdot\mathrm{cm}^{-3}$
D. 晶体中与铋离子最近且等距的氟离子有6个

A. 该铋氟化物的化学式为$\mathrm{BiF}_{3}$
B. 粒子S、T之间的距离为$\frac{\sqrt{11}}{4}a$ pm
C. 该晶体的密度为$\frac{1064}{N_{\mathrm{A}}\times a^{3}\times10^{-30}}\mathrm{g}\cdot\mathrm{cm}^{-3}$
D. 晶体中与铋离子最近且等距的氟离子有6个
答案:
D [根据题给立方晶胞及晶胞中M、N、P、Q点的截面图可知,若将晶胞均分为8个小立方体,晶胞体内的8个F⁻位于8个小立方体的体心,由均摊法可知,每个晶胞中含有铋离子个数为$1 + 12\times\frac{1}{4}=4$个,含有氟离子个数为$8 + 8\times\frac{1}{8}+6\times\frac{1}{2}=12$个,故该铋氟化物的化学式为$BiF_{3}$,A正确;以M点为原点建立坐标系,令N点的原子分数坐标为(0,0,1),Q点的原子分数坐标为(1,1,0),则T点的原子分数坐标为$(1,\frac{1}{2},\frac{1}{2})$,S点的原子分数坐标为$(\frac{1}{4},\frac{1}{4},\frac{3}{4})$,所以粒子S、T之间的距离为$\sqrt{(1 - \frac{1}{4})^{2}+(\frac{1}{2}-\frac{1}{4})^{2}+(\frac{1}{2}-\frac{3}{4})^{2}}\times a\ pm=\frac{\sqrt{11}}{4}a\ pm$,B正确;由A项分析可知,每个晶胞中有4个$Bi^{3 + }$、12个F⁻,晶胞体积为$a^{3}\times10^{-30}\ cm^{3}$,则晶体密度为$\rho=\frac{m}{V}=\frac{4\times(209 + 19\times3)}{N_{A}\times a^{3}\times10^{-30}}\ g\cdot cm^{-3}$,C正确;以晶胞体心处$Bi^{3 + }$为分析对象,距离$Bi^{3 + }$最近且等距的F⁻位于8个小立方体的体心,即有8个F⁻,D错误。]
2.(2024·湖北,11)黄金按质量分数分级,纯金为24K。$\mathrm{Au}-\mathrm{Cu}$合金的三种晶胞结构如图,Ⅱ和Ⅲ是立方晶胞。下列说法错误的是( )

A. Ⅰ为18K金
B. Ⅱ中$\mathrm{Au}$的配位数是12
C. Ⅲ中最小核间距$\mathrm{Au}-\mathrm{Cu}<\mathrm{Au}-\mathrm{Au}$
D. Ⅰ、Ⅱ、Ⅲ中,$\mathrm{Au}$与$\mathrm{Cu}$原子个数比依次为1∶1、1∶3、3∶1

A. Ⅰ为18K金
B. Ⅱ中$\mathrm{Au}$的配位数是12
C. Ⅲ中最小核间距$\mathrm{Au}-\mathrm{Cu}<\mathrm{Au}-\mathrm{Au}$
D. Ⅰ、Ⅱ、Ⅲ中,$\mathrm{Au}$与$\mathrm{Cu}$原子个数比依次为1∶1、1∶3、3∶1
答案:
C [24K金的质量分数为100%,则18K金的质量分数为$\frac{18}{24}\times100\% = 75\%$,Ⅰ中Au和Cu原子个数比值为1:1,则Au的质量分数为$\frac{197}{197 + 64}\times100\%\approx75\%$,A正确;Ⅱ中Au处于立方体的八个顶角,则Au的配位数为12,B正确;设Ⅲ的晶胞参数为a,$Au - Cu$的核间距为$\frac{\sqrt{2}}{2}a$,$Au - Au$的最小核间距也为$\frac{\sqrt{2}}{2}a$,最小核间距$Au - Cu = Au - Au$,C错误;Ⅰ中,Au处于内部,Cu处于晶胞的八个顶角,其原子个数比为1:1,Ⅱ中,Au处于立方体的八个顶角,Cu处于面心,其原子个数比为$(8\times\frac{1}{8}):(6\times\frac{1}{2}) = 1:3$,Ⅲ中,Au处于立方体的面心,Cu处于顶角,其原子个数比为$(6\times\frac{1}{2}):(8\times\frac{1}{8}) = 3:1$,D正确。]
3.(2024·湖南,12)$\mathrm{Li}_{2}\mathrm{CN}_{2}$是一种高活性的人工固氮产物,其合成反应为$2\mathrm{LiH}+\mathrm{C}+\mathrm{N}_{2}\xlongequal{高温}\mathrm{Li}_{2}\mathrm{CN}_{2}+\mathrm{H}_{2}$,晶胞如图所示,下列说法错误的是( )

A. 合成反应中,还原剂是$\mathrm{LiH}$和$\mathrm{C}$
B. 晶胞中含有的$\mathrm{Li}^{+}$个数为4
C. 每个$\mathrm{CN}_{2}^{2 - }$周围与它最近且距离相等的$\mathrm{Li}^{+}$有8个
D. $\mathrm{CN}_{2}^{2 - }$为V形结构

A. 合成反应中,还原剂是$\mathrm{LiH}$和$\mathrm{C}$
B. 晶胞中含有的$\mathrm{Li}^{+}$个数为4
C. 每个$\mathrm{CN}_{2}^{2 - }$周围与它最近且距离相等的$\mathrm{Li}^{+}$有8个
D. $\mathrm{CN}_{2}^{2 - }$为V形结构
答案:
D [反应$2LiH + C+N_{2}\stackrel{高温}{=\!=\!=}Li_{2}CN_{2}+H_{2}$中,LiH中H元素由 - 1价升高到0价,C元素由0价升高到 + 4价,N元素由0价降低到 - 3价,还原剂是LiH和C,A正确;$Li^{+}$位于晶胞中的面上,晶胞中含有的$Li^{+}$个数为$8\times\frac{1}{2}=4$,B正确;以位于体心的$CN_{2}^{2 - }$为标准,与它最近且距离相等的$Li^{+}$有8个,C正确;$CN_{2}^{2 - }$的中心原子C原子的价层电子对数为$2+\frac{1}{2}\times(4 + 2-3\times2)=2$,C原子为sp杂化,或$CN_{2}^{2 - }$与$CO_{2}$互为等电子体,可知$CN_{2}^{2 - }$为直线形分子,D错误。]
查看更多完整答案,请扫码查看


