2025年通成学典课时作业本高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年通成学典课时作业本高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第99页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
13.(2025·天津和平检测)化学与生产、生活密切相关。下列说法不正确的是 (
A.天津驰名早点果子,在炸制过程中主要涉及蛋白质变性
B.宏滦豆腐乳制作过程中需要发酵,发酵属于化学变化
C.独流老醋味香色浓,回味绵长,醋可用于除水垢
D.非物质文化遗产杨柳青木版年画所用材料的主要成分是纤维素
A
)A.天津驰名早点果子,在炸制过程中主要涉及蛋白质变性
B.宏滦豆腐乳制作过程中需要发酵,发酵属于化学变化
C.独流老醋味香色浓,回味绵长,醋可用于除水垢
D.非物质文化遗产杨柳青木版年画所用材料的主要成分是纤维素
答案:
13.A 解析:天津驰名早点果子是面食,主要成分是淀粉,A错误;豆腐乳发酵涉及微生物分解有机物,生成新物质(如氨基酸、有机酸等),属于化学变化,B正确;乙酸的酸性强于碳酸,醋(含乙酸)可与水垢(碳酸钙、氢氧化镁)反应生成可溶物,C正确;木材的主要成分为纤维素,则非物质文化遗产杨柳青木版年画所用材料的主要成分是纤维素,D正确。
14.(2025·安徽省六安第一中学检测)中国东北地区曾爆发空气重度污染,工业废气排放、机动车尾气排放、冬季燃煤采暖是导致此轮大范围空气重度污染的“元凶”。治理大气污染,任重道远!下列做法与治理大气污染相违背的是 (
A.燃煤电厂的废气随意排放
B.采暖燃煤锅炉安装脱硝等净化设施
C.尽量步行或骑自行车出行
D.重污染工业企业持续推进能源结构调整
A
)A.燃煤电厂的废气随意排放
B.采暖燃煤锅炉安装脱硝等净化设施
C.尽量步行或骑自行车出行
D.重污染工业企业持续推进能源结构调整
答案:
14.A 解析:A项,燃煤电厂的废气中含$N$、$S$的氧化物及颗粒物,均会造成空气污染,不能随意排放,应净化处理;B项,采暖燃煤锅炉安装脱硝等净化设施,减少含氮化合物的排放;C项,尽量步行或骑自行车出行,可减少化石能源的使用;D项,重污染工业企业持续推进能源结构调整,减少化石能源的使用。
15.(2025·浙江宁波期中)煤、石油和天然气仍是人类使用的主要能源,下列有关说法正确的是 (
A.煤的干馏是指将煤在空气中加强热使之分解的过程,工业上也叫煤的焦化,是煤化工的重要过程之一
B.天然气作为化工原料主要用于合成氨和生产甲醇等
C.石油经分馏得到的轻质油难以满足社会需求,需要通过裂解将重油裂解为汽油等轻质油
D.煤的气化是将煤隔绝空气加热到一定温度得到气体燃料的过程
B
)A.煤的干馏是指将煤在空气中加强热使之分解的过程,工业上也叫煤的焦化,是煤化工的重要过程之一
B.天然气作为化工原料主要用于合成氨和生产甲醇等
C.石油经分馏得到的轻质油难以满足社会需求,需要通过裂解将重油裂解为汽油等轻质油
D.煤的气化是将煤隔绝空气加热到一定温度得到气体燃料的过程
答案:
15.B 解析:煤的干馏是指将煤隔绝空气加强热使之分解的过程,工业上也叫煤的焦化,A错误;天然气作为化工原料主要用于合成氨和生产甲醇等,B正确;需要通过催化裂化过程将重油裂化为汽油等轻质油,C错误;煤的气化是将煤转化为可燃性气体的过程,主要是碳与水蒸气反应生成水煤气,不是将煤隔绝空气加热,D错误。
16.(2025·四川成都检测)海洋中有丰富的资源,如图为海水资源开发利用的部分过程。

下列有关说法正确的是 (
A.在步骤①中除去粗盐中的$SO_4^{2 - }$、$Ca^{2 + }$、$Mg^{2 + }$、$Fe^{3 + }$等杂质,加入试剂的顺序为$Na_2CO_3$溶液$\to NaOH$溶液$\to BaCl_2$溶液$\to$过滤后加盐酸
B.工业上通过电解饱和$MgCl_2$溶液制取金属镁
C.步骤④中,$SO_2$水溶液吸收$Br_2$后,溶液的$pH$增大
D.根据海水提溴流程可知还原性:$SO_2>Br^->Cl^-$

下列有关说法正确的是 (
D
)A.在步骤①中除去粗盐中的$SO_4^{2 - }$、$Ca^{2 + }$、$Mg^{2 + }$、$Fe^{3 + }$等杂质,加入试剂的顺序为$Na_2CO_3$溶液$\to NaOH$溶液$\to BaCl_2$溶液$\to$过滤后加盐酸
B.工业上通过电解饱和$MgCl_2$溶液制取金属镁
C.步骤④中,$SO_2$水溶液吸收$Br_2$后,溶液的$pH$增大
D.根据海水提溴流程可知还原性:$SO_2>Br^->Cl^-$
答案:
16.D 解析:在步骤①中除去粗盐中的$SO_4^{2-}$、$Ca^{2+}$、$Mg^{2+}$、$Fe^{3+}$等杂质时,$Na_2CO_3$溶液应在$BaCl_2$溶液之后,以除去过量的钡离子,过滤后再加盐酸,A错误;工业上通过电解熔融$MgCl_2$制取金属镁,电解饱和$MgCl_2$溶液得到氢氧化镁、氯气、氢气,得不到镁单质,B错误;步骤④是溴单质被二氧化硫水溶液吸收,生成硫酸和氢溴酸,化学方程式为$Br_2+SO_2+2H_2O=2HBr+H_2SO_4$,溶液酸性增强,溶液的pH减小,C错误;制得溴的过程中涉及的反应为氯气与溶液中的溴离子反应生成氯离子和溴、溴与二氧化硫水溶液反应生成硫酸和氢溴酸,由还原剂的还原性强于还原产物可知,还原性的强弱顺序为$SO_2>Br^->Cl^-$,D正确。
17. $SO_2$是常见的大气污染物之一,我国规定空气中$SO_2$的含量不得超过$0.02\ mg· L^{-1}$。
(1)①$SO_2$可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型酸雨。试写出这两个反应的化学方程式:
②汽车排放的尾气、硝酸厂和化肥厂的废气中都含有氮氧化物,全世界每年排放量约为$5×10^7\ kg$。$NO_2$溶于水生成
③酸雨的危害有
A. 腐蚀建筑物
B. 导致树木枯萎
C. 造成洪涝灾害
D. 恶化人类生存环境
④为了减少酸雨的形成,必须减少$SO_2$的排放量,对燃料中的硫化物进行
(2)某化学兴趣小组选用如图所示的实验装置,测定工业原料气(含$SO_2$、$N_2$、$O_2$)中$SO_2$的含量。
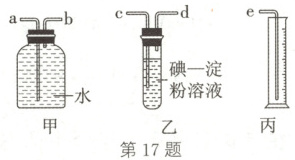
①原料气从左向右流时,上述装置连接的顺序是原料气$\to$
②写出装置乙中发生反应的离子方程式:
③下列试剂中,可以用来代替试管中碘—淀粉溶液的最优选择是
A. 酸性$KMnO_4$溶液
B. $NaOH$溶液
C. 溴水
D. 氨水
④若溶液中碘的浓度为$0.05\ mol· L^{-1}$,体积为$20\ mL$,收集到的$N_2$与$O_2$的体积为$297.6\ mL$(已折算为标准状况下的体积)。那么$SO_2$的含量是否超标?
(1)①$SO_2$可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型酸雨。试写出这两个反应的化学方程式:
2SO2+O2⇌2SO3
,SO3+H2O=H2SO4
。②汽车排放的尾气、硝酸厂和化肥厂的废气中都含有氮氧化物,全世界每年排放量约为$5×10^7\ kg$。$NO_2$溶于水生成
HNO3
(填化学式)和$NO$。③酸雨的危害有
ABD
(填字母)。A. 腐蚀建筑物
B. 导致树木枯萎
C. 造成洪涝灾害
D. 恶化人类生存环境
④为了减少酸雨的形成,必须减少$SO_2$的排放量,对燃料中的硫化物进行
脱硫处理
,对废气中的氮氧化物用碱液
吸收。(2)某化学兴趣小组选用如图所示的实验装置,测定工业原料气(含$SO_2$、$N_2$、$O_2$)中$SO_2$的含量。

①原料气从左向右流时,上述装置连接的顺序是原料气$\to$
c→d→b→a→e
(用字母和箭头表示)。②写出装置乙中发生反应的离子方程式:
$I2+SO2+2H2O=2I^-+SO4^{2-}+4H^+$
;当装置乙中出现溶液由蓝色恰好变成无色
的现象时,立即停止通气。③下列试剂中,可以用来代替试管中碘—淀粉溶液的最优选择是
A
(填字母)。A. 酸性$KMnO_4$溶液
B. $NaOH$溶液
C. 溴水
D. 氨水
④若溶液中碘的浓度为$0.05\ mol· L^{-1}$,体积为$20\ mL$,收集到的$N_2$与$O_2$的体积为$297.6\ mL$(已折算为标准状况下的体积)。那么$SO_2$的含量是否超标?
是
(填“是”或“否”)。
答案:
17.
(1)①$2SO_2+O_2\stackrel{光照}{⇌}2SO_3$ $SO_3+H_2O=H_2SO_4$
②$HNO_3$ ③ABD ④脱硫处理 碱液
(2)①$c→d→b→a→e$ ②$I_2+SO_2+2H_2O=2I^-+SO_4^{2-}+4H^+$ 溶液由蓝色恰好变成无色 ③A ④是 解析:
(2)①因废气中的$SO_2$能与$I_2$发生反应:$I_2+SO_2+2H_2O=2I^-+SO_4^{2-}+4H^+$,当装置乙中溶液由蓝色恰好变成无色时,说明$SO_2$与$I_2$恰好完全反应,根据消耗$I_2$的物质的量即可求出$SO_2$的体积,剩余气体$N_2$和$O_2$的体积可用排水法(短管进,长管出)测出,故装置的连接顺序为原料气→$c→d→b→a→e$。③$SO_2$能被酸性$KMnO_4$溶液氧化且有明显的实验现象,溴水也能与$SO_2$反应,但$Br_2$易挥发,会产生实验误差,$NaOH$溶液、氨水也能消耗$SO_2$,但无明显实验现象。④由装置乙中发生反应的离子方程式可知,$n(SO_2)=n(I_2)=0.05mol·L^{-1}×0.02L=0.001mol$,即$SO_2$的体积为$22.4mL$,所以工业原料气总体积为$297.6mL+22.4mL=320mL$,其中$SO_2$的质量为$0.001mol×64g·mol^{-1}=0.064g=64mg$,故$SO_2$的含量为$\frac{64mg}{0.32L}=200mg·L^{-1}>0.02mg·L^{-1}$,所以$SO_2$的含量超标。
(1)①$2SO_2+O_2\stackrel{光照}{⇌}2SO_3$ $SO_3+H_2O=H_2SO_4$
②$HNO_3$ ③ABD ④脱硫处理 碱液
(2)①$c→d→b→a→e$ ②$I_2+SO_2+2H_2O=2I^-+SO_4^{2-}+4H^+$ 溶液由蓝色恰好变成无色 ③A ④是 解析:
(2)①因废气中的$SO_2$能与$I_2$发生反应:$I_2+SO_2+2H_2O=2I^-+SO_4^{2-}+4H^+$,当装置乙中溶液由蓝色恰好变成无色时,说明$SO_2$与$I_2$恰好完全反应,根据消耗$I_2$的物质的量即可求出$SO_2$的体积,剩余气体$N_2$和$O_2$的体积可用排水法(短管进,长管出)测出,故装置的连接顺序为原料气→$c→d→b→a→e$。③$SO_2$能被酸性$KMnO_4$溶液氧化且有明显的实验现象,溴水也能与$SO_2$反应,但$Br_2$易挥发,会产生实验误差,$NaOH$溶液、氨水也能消耗$SO_2$,但无明显实验现象。④由装置乙中发生反应的离子方程式可知,$n(SO_2)=n(I_2)=0.05mol·L^{-1}×0.02L=0.001mol$,即$SO_2$的体积为$22.4mL$,所以工业原料气总体积为$297.6mL+22.4mL=320mL$,其中$SO_2$的质量为$0.001mol×64g·mol^{-1}=0.064g=64mg$,故$SO_2$的含量为$\frac{64mg}{0.32L}=200mg·L^{-1}>0.02mg·L^{-1}$,所以$SO_2$的含量超标。
查看更多完整答案,请扫码查看


