2025年通成学典课时作业本高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年通成学典课时作业本高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第29页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1.(2025·陕晋青宁卷改编)某元素的单质及其化合物的转化关系如图。常温、常压下,$G$、$J$均为无色气体,$J$具有漂白性。设阿伏加德罗常数的值为$N_{ A}$。下列说法错误的是(
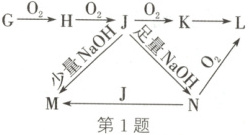
A.$G$、$K$均能与$NaOH$溶液反应
B.$H$、$N$既具有氧化性也具有还原性
C.$M$和$N$溶液中所含元素种类相同
D.$1\ mol\ G$与足量的$J$反应,转移电子数为$N_{ A}$
D
)
A.$G$、$K$均能与$NaOH$溶液反应
B.$H$、$N$既具有氧化性也具有还原性
C.$M$和$N$溶液中所含元素种类相同
D.$1\ mol\ G$与足量的$J$反应,转移电子数为$N_{ A}$
答案:
1.D 解析:根据转化关系:G$\overset{O_{2}}{ \rightarrow }$H$\overset{O_{2}}{ \rightarrow }$J$\overset{O_{2}}{ \rightarrow }$K$\overset{ }{ \rightarrow }$L,常温、常压下,G、J均为无色气体,J具有漂白性,可知J为SO₂,K为SO₃,G为H₂S,H为S,M为NaHSO₃,N为Na₂SO₃,L为Na₂SO₄。H₂S和SO₃均能与NaOH溶液反应,A正确;S和Na₂SO₃中S的化合价处于S的中间价态,既具有氧化性也具有还原性,B正确;M为NaHSO₃,N为Na₂SO₃,二者的溶液中所含元素都为Na、S、O、H,C正确;H₂S和足量的SO₂反应生成S单质和水,2H₂S+SO₂$\longrightarrow$ 3S+2H₂O,1mol H₂S参加反应,转移2mol电子,转移电子数为2Nₐ,D错误。
2.(2024·湖北卷)过量$SO_{2}$与以下$0.1\ mol· L^{-1}$的溶液反应,下列总反应的化学方程式错误的是(
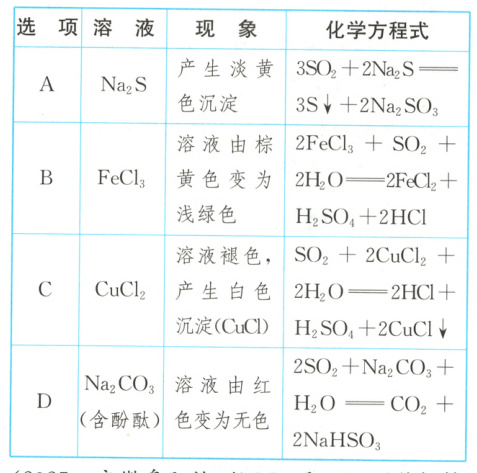
A
)
答案:
2.A 解析:过量SO₂与0.1mol·L⁻¹的Na₂S溶液反应,产生的淡黄色沉淀是S,还生成NaHSO₃,SO₂过量时不生成Na₂SO₃,因此,总反应的化学方程式为5SO₂+2Na₂S+2H₂O$\longrightarrow$ 3S↓+4NaHSO₃,A错误;过量SO₂与0.1mol·L⁻¹的FeCl₃溶液反应,生成FeCl₂、H₂SO₄、HCl,总反应的化学方程式为2FeCl₃+SO₂+2H₂O$\longrightarrow$2FeCl₂+H₂SO₄+2HCl,B正确;过量SO₂与0.1mol·L⁻¹的CuCl₂溶液反应,生成的白色沉淀是CuCl,总反应的化学方程式为SO₂+2CuCl₂+2H₂O$\longrightarrow$ 2HCl+H₂SO₄+2CuCl↓,C正确;Na₂CO₃溶液显碱性,能使酚酞溶液变红,过量SO₂与0.1mol·L⁻¹的Na₂CO₃溶液反应,生成CO₂、NaHSO₃,NaHSO₃溶液显酸性,因此,溶液由红色变为无色,总反应的化学方程式为2SO₂+Na₂CO₃+H₂O$\longrightarrow$ CO₂+2NaHSO₃,D正确。
3.(2025·安徽阜阳检测)$SO_{2}$和$Cl_{2}$两种气体的制备和性质一体化探究实验装置如图(已省略夹持装置)。下列说法正确的是(
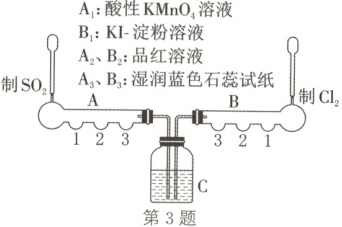
A.$A_{1}$:酸性$KMnO_{4}$溶液
B.$A_{1}$、$A_{2}$两处的溶液变色的原理相同,均体现$SO_{2}$的还原性
C.$A_{3}$、$B_{3}$两处的实验现象是一样的,都是湿润蓝色石蕊试纸变红
D.试剂瓶$C$中的溶液若是氯化钙溶液,则可能会出现白色沉淀
D
)
A.$A_{1}$:酸性$KMnO_{4}$溶液
B.$A_{1}$、$A_{2}$两处的溶液变色的原理相同,均体现$SO_{2}$的还原性
C.$A_{3}$、$B_{3}$两处的实验现象是一样的,都是湿润蓝色石蕊试纸变红
D.试剂瓶$C$中的溶液若是氯化钙溶液,则可能会出现白色沉淀
答案:
3.D 解析:采用Cu与浓硫酸反应制备SO₂时需要加热,该装置中无加热装置,A错误;A₁处的酸性KMnO₄溶液褪色体现了SO₂的还原性,原理为5SO₂+2KMnO₄+2H₂O$\longrightarrow$ 2MnSO₄+K₂SO₄+2H₂SO₄,A₂处的品红溶液遇SO₂会发生褪色,体现了SO₂的漂白性,B错误;A₃、B₃两处的实验现象不一样,A₃处的湿润蓝色石蕊试纸只变红不褪色,B₃处的湿润蓝色石蕊试纸先变红后褪色,褪色是因为生成了具有强氧化性的HClO,C错误;试剂瓶C中的溶液若是CaCl₂溶液,则可能会出现白色沉淀,发生反应的离子方程式为SO₂+Cl₂+2H₂O+Ca²⁺$\longrightarrow$ CaSO₄↓+2Cl⁻+4H⁺,D正确。
4.(2025·湖北武汉期中)同温、同压下,在两个容积相同的圆底烧瓶中分别充满相应的气体后,打开弹簧夹,挤出胶头滴管中的水,两烧瓶中都可产生“喷泉”(如图)。对两瓶“喷泉”的比较,下列说法错误的是(
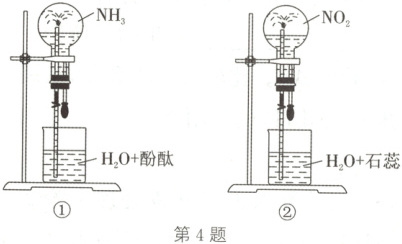
A.两烧瓶中气体颜色不同,两“喷泉”溶液都是红色
B.“喷泉”后烧瓶中溶液的$pH$:①大于②
C.“喷泉”后烧瓶中溶液的体积:①大于②
D.“喷泉”后烧瓶中溶液的物质的量浓度:①大于②
D
)
A.两烧瓶中气体颜色不同,两“喷泉”溶液都是红色
B.“喷泉”后烧瓶中溶液的$pH$:①大于②
C.“喷泉”后烧瓶中溶液的体积:①大于②
D.“喷泉”后烧瓶中溶液的物质的量浓度:①大于②
答案:
4.D 解析:氨是无色气体,溶于水所得氨水呈碱性,能使酚酞溶液变红,NO₂是红棕色气体,溶于水可生成硝酸,能使石蕊溶液变红,故气体颜色不同,“喷泉”颜色都呈红色,A正确;氨溶于水后溶液呈碱性,NO₂溶于水后溶液呈酸性,前者pH大,B正确;①中氨完全溶解,溶液的体积等于氨的体积,②中发生反应:3NO₂+H₂O$\longrightarrow$ 2HNO₃+NO,溶液的体积等于NO₂的体积的$\frac{2}{3}$,C正确;①中氨完全溶解,溶液的体积等于氨的体积,所得溶液浓度为$\frac{VL}{V_mL}$ =$\frac{1}{V_m}$mol/L,②中发生反应:3NO₂+H₂O$\longrightarrow$ 2HNO₃+NO,VL二氧化氮反应得到$\frac{1}{3}$VLNO,溶液的体积为$\frac{2}{3}$VL,而有$\frac{2}{3}$VL的NO₂转化为硝酸,溶液浓度为$\frac{\frac{2}{3}VL}{V_m\frac{2}{3}VL}$ =$\frac{1}{V_m}$mol/L,故溶液的物质的量浓度为①=②,D错误。
5.(2024·北京卷)$HNO_{3}$是一种重要的工业原料。可采用不同的氮源制备$HNO_{3}$。
(1)方法一:早期以硝石(含$NaNO_{3}$)为氮源制备$HNO_{3}$,发生反应的化学方程式为$H_{2}SO_{4}(浓)+NaNO_{3}═NaHSO_{4}+HNO_{3}↑$。该反应利用了浓硫酸的酸性和
(2)方法二:以$NH_{3}$为氮源催化氧化制备$HNO_{3}$,反应原理分三步进行,如图。

第Ⅰ步反应的化学方程式为
(1)方法一:早期以硝石(含$NaNO_{3}$)为氮源制备$HNO_{3}$,发生反应的化学方程式为$H_{2}SO_{4}(浓)+NaNO_{3}═NaHSO_{4}+HNO_{3}↑$。该反应利用了浓硫酸的酸性和
难挥发性
。(2)方法二:以$NH_{3}$为氮源催化氧化制备$HNO_{3}$,反应原理分三步进行,如图。

第Ⅰ步反应的化学方程式为
4NH₃+5O₂$\underset{△}{\overset{催化剂}{ \longrightarrow }}$4NO+6H₂O
。
答案:
5.
(1)难挥发性
(2)4NH₃+5O₂$\underset{△}{\overset{催化剂}{ \longrightarrow }}$4NO+6H₂O 解析:
(1)浓硫酸难挥发,产物HNO₃易挥发,有利于复分解反应进行,体现了浓硫酸的酸性和难挥发性。
(2)第Ⅰ步反应为氨的催化氧化,化学方程式为4NH₃+5O₂$\underset{△}{\overset{催化剂}{ \longrightarrow }}$4NO+6H₂O。
(1)难挥发性
(2)4NH₃+5O₂$\underset{△}{\overset{催化剂}{ \longrightarrow }}$4NO+6H₂O 解析:
(1)浓硫酸难挥发,产物HNO₃易挥发,有利于复分解反应进行,体现了浓硫酸的酸性和难挥发性。
(2)第Ⅰ步反应为氨的催化氧化,化学方程式为4NH₃+5O₂$\underset{△}{\overset{催化剂}{ \longrightarrow }}$4NO+6H₂O。
查看更多完整答案,请扫码查看


