2025年通成学典课时作业本高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年通成学典课时作业本高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第39页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
5. (2025·江苏连云港检测)化学反应:$4 A(g) + 5B(g) \longrightarro 4C(g) + 6D(g)$,在4种不同情况下的化学反应速率分别为①$v (A) = 0.2 mol· L^{-1}· s^{-1}$;②$v (B) = 0.45 mol· L^{-1}· s^{-1}$;③$v (C) = 0.3 mol· L^{-1}· s^{-1}$;④$v (D) = 0.45 mol· L^{-1}· s^{-1}$。下列有关化学反应速率的比较中正确的是(
A.①>②>③>④
B.①<③=④<②
C.②=④>③>①
D.②<①<④<③
B
)A.①>②>③>④
B.①<③=④<②
C.②=④>③>①
D.②<①<④<③
答案:
5. B 解析:化学反应中,物质的化学反应速率与化学计量数的比值越大,化学反应速率越大,由题中数据可得:① $\frac{v( A)}{4} = 0.05 mol·L^{-1}· s^{-1}$、② $\frac{v( B)}{5} = 0.09 mol·L^{-1}· s^{-1}$、③ $\frac{v( C)}{4} = 0.075 mol·L^{-1}· s^{-1}$、④ $\frac{v( D)}{6} = 0.075 mol·L^{-1}· s^{-1}$,故化学反应速率:①<③=④<②。
6. (2025·广西柳州期中)一定温度下,在$2\ L$恒容密闭容器中,$ A$、$ B$、$ C$三种气体的物质的量随时间变化的曲线如图所示,下列说法错误的是(
A.同一段时间内,一定存在:$3v (A) = 2v(B)$
B.反应的化学方程式为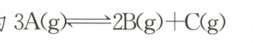
C.$0\sim5\ \min$内,$ C$的平均反应速率为$0.02\ mol/(L· min)$
D.反应过程中,混合气体的压强保持不变
A
)
A.同一段时间内,一定存在:$3v (A) = 2v(B)$
B.反应的化学方程式为
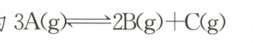
C.$0\sim5\ \min$内,$ C$的平均反应速率为$0.02\ mol/(L· min)$
D.反应过程中,混合气体的压强保持不变
答案:
6. A 解析:反应到 $5 min$ 时,存在 $\Delta n( A):\Delta n( B):\Delta n( C) = (0.8 - 0.2) mol:(0.4 - 0) mol:(0.2 - 0) mol = 3:2:1$,结合图中物质的量的变化趋势可知反应的化学方程式为 $3 A(g) \rightleftharpoons 2 B(g) + C(g)$,B 正确;根据反应速率之比等于化学计量数之比可得,同一段时间内,一定存在:$2v( A) = 3v( B)$,A 错误;$0~5 min$ 内,$v( C) = \frac{\Delta n( C)}{V · \Delta t} = \frac{0.2 - 0}{2 × 5} mol/(L·min) = 0.02 mol/(L·min)$,C 正确;由于温度、容器容积不变,反应前后气体的物质的量不变,则混合气体的压强保持不变,D 正确。
7. (2025·黑龙江鹤岗检测)一定温度下,向一个$2\ L$的密闭容器中通入等物质的量的$ A$和$ B$,发生反应:$ A(g) + B(g) \longrightarro C(g) + x D(g)$,经$2\ \min$后测得$ C$的浓度为$0.5\ mol· L^{-1}$,$n (A):n (D) = 2:3$,用$ D$表示的平均反应速率$v (D) = 0.75 mol· L^{-1}· min^{-1}$。下列说法错误的是(
A.用$ B$表示的平均反应速率$v (B) = 0.25 mol· L^{-1}· min^{-1}$
B.该化学方程式中,$x = 3$
C.$2\ \min$时,$ A$的转化率为$50\%$
D.$2\ \min$时,$ A$的浓度为$1\ mol· L^{-1}$
C
)A.用$ B$表示的平均反应速率$v (B) = 0.25 mol· L^{-1}· min^{-1}$
B.该化学方程式中,$x = 3$
C.$2\ \min$时,$ A$的转化率为$50\%$
D.$2\ \min$时,$ A$的浓度为$1\ mol· L^{-1}$
答案:
7. C 解析:$2 min$ 后生成的 C 的物质的量为 $0.5 mol·L^{-1} × 2 L = 1 mol$,生成的 D 的物质的量为 $0.75 mol·L^{-1}· min^{-1} × 2 min × 2 L = 3 mol$,物质的量改变量之比等于化学计量数之比,故 $x = 3$,B 正确。假设起始时通入的 A、B 的物质的量均为 $a mol$,根据相关数据列三段式如下:
$ A(g) + B(g) \longrightarrow C(g) + 3 D(g)$
起始$/ mol$ $a$ $a$ $0$ $0$
转化$/ mol$ $1$ $1$ $1$ $3$
$2 min$ 时$/ mol$ $a - 1$ $a - 1$ $1$ $3$
$2 min$ 时,$n( A):n( D) = 2:3$,则 $a - 1 = 2$,$a = 3$。由上述分析可知,用 B 表示的平均反应速率 $v( B) = \frac{1 mol}{2 L × 2 min} = 0.25 mol·L^{-1}· min^{-1}$,A 正确。$2 min$ 时,A 的转化率为 $\frac{1 mol}{3 mol} × 100\% \approx 33.3\%$,C 错误。$2 min$ 时,A 的物质的量为 $2 mol$,A 的浓度为 $1 mol·L^{-1}$,D 正确。
$ A(g) + B(g) \longrightarrow C(g) + 3 D(g)$
起始$/ mol$ $a$ $a$ $0$ $0$
转化$/ mol$ $1$ $1$ $1$ $3$
$2 min$ 时$/ mol$ $a - 1$ $a - 1$ $1$ $3$
$2 min$ 时,$n( A):n( D) = 2:3$,则 $a - 1 = 2$,$a = 3$。由上述分析可知,用 B 表示的平均反应速率 $v( B) = \frac{1 mol}{2 L × 2 min} = 0.25 mol·L^{-1}· min^{-1}$,A 正确。$2 min$ 时,A 的转化率为 $\frac{1 mol}{3 mol} × 100\% \approx 33.3\%$,C 错误。$2 min$ 时,A 的物质的量为 $2 mol$,A 的浓度为 $1 mol·L^{-1}$,D 正确。
8. 将等物质的量的$ A$、$ B$混合于$2\ L$的密闭容器中,发生如下反应:$3 A(g) + B(g) \longrightarro x C(g) + 2D(g)$,经$5\ \min$后,测得$ D$的浓度为$0.5\ mol· L^{-1}$,$c (A):c (B) = 3:5$,$ C$的平均反应速率为$0.1\ mol· L^{-1}· min^{-1}$。求:
(1)此时$ A$的浓度$c (A) = $
(2)$5\ \min$内,$ B$的平均反应速率$v (B) = $
(3)$x$的值为
(1)此时$ A$的浓度$c (A) = $
0.75
$ mol· L^{-1}$,反应开始前容器中的$ A$、$ B$的物质的量$n (A) = n(B) = $3
$ mol$。(2)$5\ \min$内,$ B$的平均反应速率$v (B) = $
0.05
$ mol· L^{-1}· min^{-1}$。(3)$x$的值为
2
。
答案:
8.
(1) $0.75$ $3$
(2) $0.05$
(3) $2$ 解析:
(1) 经 $5 min$ 后生成 D 的物质的量 $n( D) = 0.5 mol·L^{-1} × 2 L = 1 mol$,根据该反应的化学方程式可知,生成 $1 mol$ D 要消耗 $1.5 mol$ A 和 $0.5 mol$ B,设 A、B 的初始物质的量均为 $y mol$,则 $(y - 1.5) mol:(y - 0.5) mol = 3:5$,解得 $y = 3$;则 $c( A) = \frac{(3 - 1.5) mol}{2 L} = 0.75 mol·L^{-1}$。
(2) $v( B) = \frac{0.5 mol}{2 L × 5 min} = 0.05 mol·L^{-1}· min^{-1}$。
(3) 根据题中数据可知,经 $5 min$ 后生成 C 的物质的量 $n( C) = 0.1 mol·L^{-1}· min^{-1} × 5 min × 2 L = 1 mol$,$n( D) = 1 mol$,根据该反应的化学方程式可知,$n( C):n( D) = x:2 = 1 mol:1 mol = 1:1$,即 $x = 2$。
(1) $0.75$ $3$
(2) $0.05$
(3) $2$ 解析:
(1) 经 $5 min$ 后生成 D 的物质的量 $n( D) = 0.5 mol·L^{-1} × 2 L = 1 mol$,根据该反应的化学方程式可知,生成 $1 mol$ D 要消耗 $1.5 mol$ A 和 $0.5 mol$ B,设 A、B 的初始物质的量均为 $y mol$,则 $(y - 1.5) mol:(y - 0.5) mol = 3:5$,解得 $y = 3$;则 $c( A) = \frac{(3 - 1.5) mol}{2 L} = 0.75 mol·L^{-1}$。
(2) $v( B) = \frac{0.5 mol}{2 L × 5 min} = 0.05 mol·L^{-1}· min^{-1}$。
(3) 根据题中数据可知,经 $5 min$ 后生成 C 的物质的量 $n( C) = 0.1 mol·L^{-1}· min^{-1} × 5 min × 2 L = 1 mol$,$n( D) = 1 mol$,根据该反应的化学方程式可知,$n( C):n( D) = x:2 = 1 mol:1 mol = 1:1$,即 $x = 2$。
9. (选做题)(2024·陕西榆林期末)向某温度恒定、容积固定的密闭容器中加入$0.3\ mol\ A(g)$、$0.1\ mol\ C(g)$和一定量的$ B(g)$,一定条件下发生反应,各物质的浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。下列说法错误的是(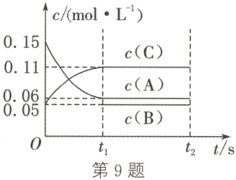
A.密闭容器的容积为$2\ L$
B.$ B$的起始浓度是$0.02\ mol· L^{-1}$
C.反应的化学方程式为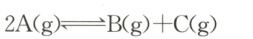
D.若$t_1 = 10$,则$0\sim t_1\ s$内以$ A$的浓度变化表示的平均反应速率为$0.009\ mol· L^{-1}· s^{-1}$
C
)
A.密闭容器的容积为$2\ L$
B.$ B$的起始浓度是$0.02\ mol· L^{-1}$
C.反应的化学方程式为
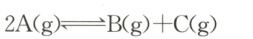
D.若$t_1 = 10$,则$0\sim t_1\ s$内以$ A$的浓度变化表示的平均反应速率为$0.009\ mol· L^{-1}· s^{-1}$
答案:
9. C 解析:根据图像,$0~t_1 s$ 内 A 的浓度减少 $0.15 mol·L^{-1} - 0.06 mol·L^{-1} = 0.09 mol·L^{-1}$,A 为反应物,C 的浓度增加 $0.11 mol·L^{-1} - 0.05 mol·L^{-1} = 0.06 mol·L^{-1}$,C 为生成物;A、C 的化学计量数之比为 $0.09 mol·L^{-1}:0.06 mol·L^{-1} = 3:2$;在反应过程中混合气体的平均相对分子质量没有变化,即反应前后气体分子数不变,则 B 为生成物,反应的化学方程式为 $3 A(g) \longrightarrow B(g) + 2 C(g)$,C 错误。起始加入 A 的物质的量为 $0.3 mol$,A 的起始浓度为 $0.15 mol·L^{-1}$,则密闭容器的容积为 $\frac{0.3 mol}{0.15 mol·L^{-1}} = 2 L$,A 正确。根据转化浓度之比等于化学计量数之比,$0~t_1 s$ 内 B 的浓度增加 $0.03 mol·L^{-1}$,$t_1 s$ 时 B 的浓度为 $0.05 mol·L^{-1}$,则 B 的起始浓度为 $0.05 mol·L^{-1} - 0.03 mol·L^{-1} = 0.02 mol·L^{-1}$,B 正确。若 $t_1 = 10$,则 $0~t_1 s$ 内以 A 的浓度变化表示的平均反应速率 $v( A) = \frac{0.15 mol·L^{-1} - 0.06 mol·L^{-1}}{10 s} = 0.009 mol·L^{-1}· s^{-1}$,D 正确。
查看更多完整答案,请扫码查看


