2025年通成学典课时作业本高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年通成学典课时作业本高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第50页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
2. 多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现$T\ \mathrm{^{\circ}C}$时(各物质均为气态),甲醇($\mathrm{CH}_{3}\mathrm{OH}$)与水在铜基催化剂上生成$\mathrm{CO}_{2}$的反应机理和能量图如图。下列说法正确的是 (
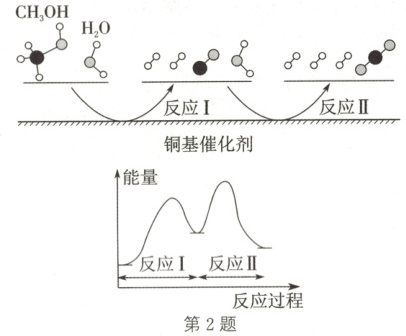
A.反应Ⅰ和Ⅱ过程中均存在极性键和非极性键的断裂与形成
B.$1\ \mathrm{mol}\ \mathrm{CH}_{3}\mathrm{OH(g)}$和$1\ \mathrm{mol}\ \mathrm{H}_{2}\mathrm{O(g)}$的总能量大于$1\ \mathrm{mol}\ \mathrm{CO}_{2}\mathrm{(g)}$和$3\ \mathrm{mol}\ \mathrm{H}_{2}\mathrm{(g)}$的总能量
C.$\mathrm{CO}$是该反应的催化剂
D.反应Ⅰ中每生成$2\ \mathrm{mol}\ \mathrm{H}_{2}$,转移电子$4\ \mathrm{mol}$
D
)
A.反应Ⅰ和Ⅱ过程中均存在极性键和非极性键的断裂与形成
B.$1\ \mathrm{mol}\ \mathrm{CH}_{3}\mathrm{OH(g)}$和$1\ \mathrm{mol}\ \mathrm{H}_{2}\mathrm{O(g)}$的总能量大于$1\ \mathrm{mol}\ \mathrm{CO}_{2}\mathrm{(g)}$和$3\ \mathrm{mol}\ \mathrm{H}_{2}\mathrm{(g)}$的总能量
C.$\mathrm{CO}$是该反应的催化剂
D.反应Ⅰ中每生成$2\ \mathrm{mol}\ \mathrm{H}_{2}$,转移电子$4\ \mathrm{mol}$
答案:
2.D 解析:反应Ⅰ没有非极性键的断裂,反应Ⅱ没有非极性键的断裂,A错误;根据图示,1 mol CH₃OH(g)和 1 mol H₂O(g)的总能量小于 1 mol CO₂(g)和 3 mol H₂(g)的总能量,B错误;反应Ⅰ生成 CO,反应Ⅱ消耗 CO,故 CO 是该反应的中间产物,C错误;H元素的化合价从 +1 降低为 0,故反应Ⅰ中每生成 2 mol H₂,转移电子 4 mol,D正确。
3. (2024·湖南卷)近年来,我国新能源产业得到了蓬勃发展,下列说法错误的是 (
A.理想的新能源应具有资源丰富、可再生、对环境无污染等特点
B.氢氧燃料电池具有能量转化率高、清洁等优点
C.锂离子电池放电时锂离子从负极脱嵌,充电时锂离子从正极脱嵌
D.太阳能电池是一种将化学能转化为电能的装置
D
)A.理想的新能源应具有资源丰富、可再生、对环境无污染等特点
B.氢氧燃料电池具有能量转化率高、清洁等优点
C.锂离子电池放电时锂离子从负极脱嵌,充电时锂离子从正极脱嵌
D.太阳能电池是一种将化学能转化为电能的装置
答案:
3.D 解析:理想的新能源应具有可再生、无污染等特点,A 正确;氢氧燃料电池利用原电池将化学能转化为电能,对氢气与氧气反应的能量进行利用,减少了直接燃烧的热量散失,产物无污染,故具有能量转化率高、清洁等优点,B 正确;脱嵌是锂从电极材料中出来的过程,放电时,负极材料产生锂离子,则锂离子从负极脱嵌,充电时,锂离子从正极脱嵌,C 正确;太阳能电池是一种将太阳能转化为电能的装置,D 错误。
4. (2024·江苏卷)碱性锌锰电池的总反应为$\mathrm{Zn} + 2\mathrm{MnO}_{2} + \mathrm{H}_{2}\mathrm{O} \longrightarrow \mathrm{ZnO} + 2\mathrm{MnOOH}$,电池构造示意图如图所示。下列有关说法正确的是 (

A.电池工作时,$\mathrm{MnO}_{2}$发生氧化反应
B.电池工作时,$\mathrm{OH}^{-}$通过隔膜向正极移动
C.环境温度过低,不利于电池放电
D.反应中每生成$1\ \mathrm{mol}\ \mathrm{MnOOH}$,转移电子数为$2×6.02×10^{23}$
C
)
A.电池工作时,$\mathrm{MnO}_{2}$发生氧化反应
B.电池工作时,$\mathrm{OH}^{-}$通过隔膜向正极移动
C.环境温度过低,不利于电池放电
D.反应中每生成$1\ \mathrm{mol}\ \mathrm{MnOOH}$,转移电子数为$2×6.02×10^{23}$
答案:
4.C 解析:Zn 为负极,电极反应式为 Zn−2e⁻ + 2OH⁻ = ZnO + H₂O,MnO₂ 为正极,电极反应式为 MnO₂ + e⁻ + H₂O = MnOOH + OH⁻。电池工作时,MnO₂ 为正极,得到电子,发生还原反应,A 错误;电池工作时,OH⁻ 通过隔膜向负极移动,B 错误;环境温度过低,化学反应速率减小,不利于电池放电,C 正确;由正极反应式 MnO₂ + e⁻ + H₂O = MnOOH + OH⁻ 可知,反应中每生成 1 mol MnOOH,转移电子数为 6.02×10²³,D 错误。
5. 负载有$\mathrm{Pt}$和$\mathrm{Ag}$的活性炭,可选择性去除$\mathrm{Cl}^{-}$实现废酸的纯化,其工作原理如图。下列说法正确的是(

A.$\mathrm{Ag}$作原电池的正极
B.电子由$\mathrm{Ag}$经活性炭流向$\mathrm{Pt}$
C.$\mathrm{Pt}$表面发生的电极反应:$\mathrm{O}_{2} + 2\mathrm{H}_{2}\mathrm{O} + 4\mathrm{e}^{-}\longrightarrow4\mathrm{OH}^{-}$
D.每消耗标准状况下$11.2\ \mathrm{L}\ \mathrm{O}_{2}$,最多去除$1\ \mathrm{mol}\ \mathrm{Cl}^{-}$
B
)
A.$\mathrm{Ag}$作原电池的正极
B.电子由$\mathrm{Ag}$经活性炭流向$\mathrm{Pt}$
C.$\mathrm{Pt}$表面发生的电极反应:$\mathrm{O}_{2} + 2\mathrm{H}_{2}\mathrm{O} + 4\mathrm{e}^{-}\longrightarrow4\mathrm{OH}^{-}$
D.每消耗标准状况下$11.2\ \mathrm{L}\ \mathrm{O}_{2}$,最多去除$1\ \mathrm{mol}\ \mathrm{Cl}^{-}$
答案:
5.B 解析:O₂ 在 Pt 表面得到电子发生还原反应,Pt 为正极,Ag 失去电子发生氧化反应,Ag 为负极。由分析可知,Ag 作原电池的负极,A 项错误;电子由负极 Ag 经活性炭流向正极 Pt,B 项正确;溶液呈酸性,故 Pt 表面发生的电极反应为 O₂ + 4H⁺ + 4e⁻ = 2H₂O,C 项错误;每消耗标准状况下 11.2 L O₂,转移 2 mol 电子,而 2 mol Ag 失去 2 mol 电子,结合 2 mol Cl⁻,即最多去除 2 mol Cl⁻,D 项错误。
6. (2024·甘肃卷改编)下列措施能减小化学反应速率的是 (
A.催化氧化氨制备硝酸时加入铂
B.在试管中进行中和反应实验时,振荡试管
C.锌粉和盐酸反应时加水稀释
D.石墨合成金刚石时增大压强
C
)A.催化氧化氨制备硝酸时加入铂
B.在试管中进行中和反应实验时,振荡试管
C.锌粉和盐酸反应时加水稀释
D.石墨合成金刚石时增大压强
答案:
6.C 解析:A 项,催化剂可以改变化学反应速率,一般来说,催化剂可以增大化学反应速率,故催化氧化氨制备硝酸时加入铂,铂作催化剂,可以增大化学反应速率;B 项,在试管中进行中和反应实验时,振荡试管可增大化学反应速率;C 项,锌粉和盐酸反应时加水稀释会降低盐酸的浓度,会减小化学反应速率;D 项,石墨合成金刚石,该反应中没有气体参与,增大压强不会改变化学反应速率。
查看更多完整答案,请扫码查看


