2025年通成学典课时作业本高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年通成学典课时作业本高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第2页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
6. (2024·江苏盐城期末)实验室需要制备少量${SO_{2}}$并验证其性质,下列实验装置不能达到相应实验目的的是(

B
)
答案:
6.B 解析:A项,实验室常用Na₂SO₃固体与70%的硫酸溶液反应制取SO₂,反应不需要加热,装置能达到实验目的;B项,二氧化硫和碘单质、水发生氧化还原反应,消耗了碘单质,使得含有淀粉的碘水褪色,体现二氧化硫的还原性,而不是二氧化硫的漂白性,装置不能达到实验目的;C项,二氧化硫的密度大于空气,因此用向上排空气法收集,装置能达到实验目的;D项,二氧化硫有毒,为防止污染空气,需要除去,常用碱液吸收,装置能达到实验目的。
7. 科学探究 将${SO_{2}}$分别通入如图所示的五种溶液中,回答下列问题:
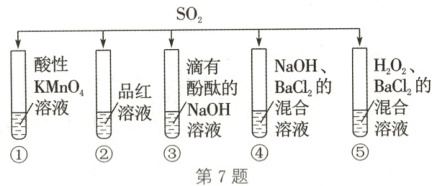
(1)试管①中的实验现象:溶液
(2)试管②中的实验现象:溶液
(3)试管③中的实验现象:溶液
(4)试管④中能产生
(5)试管⑤中能产生白色沉淀,该沉淀是

(1)试管①中的实验现象:溶液
褪色
,证明${SO_{2}}$具有还原
性。(2)试管②中的实验现象:溶液
褪色
,证明${SO_{2}}$具有漂白
性。(3)试管③中的实验现象:溶液
褪色
,证明${SO_{2}}$能与$NaOH$反应,写出该反应的离子方程式:SO₂+2OH⁻=SO₃²⁻+H₂O(或SO₂+OH⁻=HSO₃⁻)
。(4)试管④中能产生
白色
沉淀,该沉淀是BaSO₃
(填化学式)。(5)试管⑤中能产生白色沉淀,该沉淀是
BaSO₄
(填化学式)。
答案:
7.(1)褪色 还原 (2)褪色 漂白 (3)褪色 SO₂+2OH⁻=SO₃²⁻+H₂O(或SO₂+OH⁻=HSO₃⁻)
(4)白色 BaSO₃ (5)BaSO₄ 解析:(3)二氧化硫和OH⁻反应,溶液碱性变弱,溶液褪色。(4)二氧化硫和氢氧化钠、氯化钡的混合溶液反应生成白色沉淀BaSO₃。
(5)二氧化硫和过氧化氢、氯化钡的混合溶液反应生成白色沉淀BaSO₄。
(4)白色 BaSO₃ (5)BaSO₄ 解析:(3)二氧化硫和OH⁻反应,溶液碱性变弱,溶液褪色。(4)二氧化硫和氢氧化钠、氯化钡的混合溶液反应生成白色沉淀BaSO₃。
(5)二氧化硫和过氧化氢、氯化钡的混合溶液反应生成白色沉淀BaSO₄。
8. 按如图装置进行实验,将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是(已知:${Na_{2}S_{2}O_{3} + H_{2}SO_{4}\xlongequal{}Na_{2}SO_{4} + SO_{2}\uparrow + S\downarrow + H_{2}O}$)(

A.Ⅰ中试管内的反应体现${H^{+}}$的氧化性
B.Ⅱ中品红溶液褪色,体现${SO_{2}}$的还原性
C.Ⅰ和Ⅲ的试管中都出现了浑浊现象
D.撤掉水浴,重做实验,Ⅳ中红色更快褪去
C
)
A.Ⅰ中试管内的反应体现${H^{+}}$的氧化性
B.Ⅱ中品红溶液褪色,体现${SO_{2}}$的还原性
C.Ⅰ和Ⅲ的试管中都出现了浑浊现象
D.撤掉水浴,重做实验,Ⅳ中红色更快褪去
答案:
8.C 解析:本题考查二氧化硫的制备与性质实验。Ⅰ中试管内发生反应:S₂O₃²⁻+2H⁺=S↓+SO₂↑+H₂O,二氧化硫进入Ⅱ中使品红溶液褪色,二氧化硫进入Ⅲ中与硫化钠反应生成S沉淀,二氧化硫进入Ⅳ中与氢氧化钠反应使溶液碱性减弱,溶液褪色。Ⅰ中试管内发生反应:S₂O₃²⁻+2H⁺=S↓+SO₂↑+H₂O,氢元素的化合价不变,H⁺不体现氧化性,A项错误;Ⅱ中品红溶液褪色,体现SO₂的漂白性,B项错误;Ⅰ的试管内发生反应:S₂O₃²⁻+2H⁺=S↓+SO₂↑+H₂O,Ⅲ的试管内发生反应:5SO₂+2Na₂S+2H₂O=3S↓+4NaHSO₃,Ⅰ和Ⅲ的试管中都出现了浑浊现象,C项正确;撤掉水浴,重做实验,反应速率减小,Ⅳ中红色慢褪去,D项错误。
9. 下列有关说法错误的是(
A.${SO_{2}}$、活性炭都有漂白性,但二者漂白原理不同
B.除去${SO_{2}}$中的少量$HCl$气体:将混合气体依次通过亚硫酸氢钠饱和溶液和浓硫酸
C.将某气体通入品红溶液中,品红溶液褪色,该气体一定是${SO_{2}}$
D.除去${CO_{2}}$中的${SO_{2}}$:将气体依次通过足量酸性${KMnO_{4}}$溶液和浓硫酸
C
)A.${SO_{2}}$、活性炭都有漂白性,但二者漂白原理不同
B.除去${SO_{2}}$中的少量$HCl$气体:将混合气体依次通过亚硫酸氢钠饱和溶液和浓硫酸
C.将某气体通入品红溶液中,品红溶液褪色,该气体一定是${SO_{2}}$
D.除去${CO_{2}}$中的${SO_{2}}$:将气体依次通过足量酸性${KMnO_{4}}$溶液和浓硫酸
答案:
9.C 解析:SO₂的漂白原理是与有色物质反应生成无色物质,活性炭的漂白原理是利用其吸附性,A正确;HCl与亚硫酸氢钠饱和溶液反应生成二氧化硫,再通过浓硫酸,可除去SO₂中混有的水蒸气,B正确;能使品红溶液褪色的气体有SO₂、Cl₂、O₃等,C错误;SO₂具有还原性,CO₂没有,酸性KMnO₄溶液具有氧化性,因此可用酸性KMnO₄溶液除去CO₂中的SO₂,再通过浓硫酸,可除去CO₂中混有的水蒸气,D正确。
10. 如图所示,利用培养皿探究${SO_{2}}$的性质。实验时向${Na_{2}SO_{3}}$固体上滴几滴浓硫酸,立即用另一培养皿扣在上面。表中对实验现象的解释不正确的是(


A.①②
B.②③
C.③④
D.①④
C
)

A.①②
B.②③
C.③④
D.①④
答案:
10.C 解析:Na₂SO₃固体上滴几滴浓硫酸会生成二氧化硫。SO₂+Ba(OH)₂=BaSO₃↓+H₂O,Ba(OH)₂溶液变浑浊,①正确;SO₂与Na₂S溶液反应生成S单质,Na₂S溶液变浑浊,②正确;SO₂使KMnO₄溶液褪色是因为SO₂具有还原性,③错误;SO₂消耗了NaOH,使含有酚酞的NaOH溶液褪色,不是因为SO₂具有漂白性,④错误。
查看更多完整答案,请扫码查看


