2025年通成学典课时作业本高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年通成学典课时作业本高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第37页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
9. (2025·福建福州期中)理论上,任何自发的氧化还原反应都可以设计成原电池。某同学利用反应Cu + 2Ag⁺ = Cu²⁺ + 2Ag设计了一个化学电池(如图所示)。在该电池外电路中,电流从a极流向b极。下列说法正确的是(
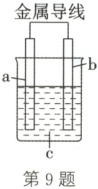
A.装置放电时主要将电能转化为化学能
B.a极可以为Ag,也可以是石墨或铁
C.b极为铜,电极反应式为Cu - 2e⁻ = Cu²⁺
D.c溶液为AgNO₃溶液,放电时Ag⁺向b极移动
C
)
A.装置放电时主要将电能转化为化学能
B.a极可以为Ag,也可以是石墨或铁
C.b极为铜,电极反应式为Cu - 2e⁻ = Cu²⁺
D.c溶液为AgNO₃溶液,放电时Ag⁺向b极移动
答案:
9.C 解析:在该电池外电路中,电流从a极流向b极,则a极为正极、b极为负极;根据原电池总反应:${Cu + 2Ag^{+} = Cu^{2+} + 2Ag}$可知,b极为铜,a极为活动性弱于Cu的金属或能导电的非金属,c溶液为${AgNO_{3}}$溶液。原电池装置放电时主要将化学能转化为电能,A错误;a极可以为Ag或石墨,但不能为铁,B错误;b极为铜,电极反应式为${Cu - 2e^{-} = Cu^{2+}}$,C正确;原电池中阳离子向正极移动,故放电时${Ag^{+}}$向a极移动,D错误。
10. 将两根质量相同的铜棒和锌棒用导线相连接后插入CuSO₄溶液中,经过一段时间后取出,洗净后干燥并称量,两棒质量相差6.45g,导线中通过的电子的物质的量为(
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
A
)A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
答案:
10.A 解析:负极:${Zn - 2e^{-} = Zn^{2+}}$,1 mol Zn失去2 mol电子,质量减小65 g;正极:${Cu^{2+} + 2e^{-} = Cu}$,1 mol ${Cu^{2+}}$得到2 mol电子,质量增大64 g;此时两极质量相差:65 g + 64 g = 129 g。若两棒质量相差6.45 g,则参加反应的锌及生成的铜均为0.05 mol,转移0.1 mol电子。
11. (2025·河南南阳期中)双功能催化剂W - CoP - NF可应用于KOH - N₂H₄燃料电池,装置如图(注:OH⁻交换膜只允许OH⁻通过)。下列说法错误的是(
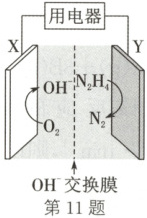
A.Y极处发生氧化反应
B.OH⁻通过交换膜向右移动
C.X极的电极反应式为O₂ - 4e⁻ + 2H₂O = 4OH⁻
D.当消耗32g N₂H₄时,理论上电路中转移4mol电子
C
)
A.Y极处发生氧化反应
B.OH⁻通过交换膜向右移动
C.X极的电极反应式为O₂ - 4e⁻ + 2H₂O = 4OH⁻
D.当消耗32g N₂H₄时,理论上电路中转移4mol电子
答案:
11.C 解析:${KOH - N_{2}H_{4}}$燃料电池中${N_{2}H_{4}}$发生氧化反应生成氮气,则Y极为负极,X极为正极,A正确;Y极为负极,原电池中阴离子向负极移动,${OH^{-}}$通过交换膜向右移动,B正确;X极为正极,电极反应式为${O_{2} + 4e^{-} + 2H_{2}O = 4OH^{-}}$,C错误;Y极为负极,电极反应式为${N_{2}H_{4} - 4e^{-} + 4OH^{-} = N_{2} + 4H_{2}O}$,当消耗32 g ${N_{2}H_{4}}$(1 mol)时,理论上电路中转移1 mol×2×2 = 4 mol电子,D正确。
12. A、B、C、D四种金属按表中装置进行实验。
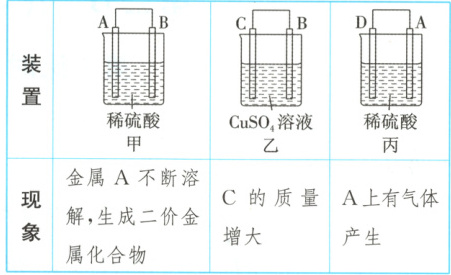
根据实验现象,回答下列问题:
(1)装置甲中负极的电极反应式为
(2)装置乙中正极的电极反应式为
(3)装置丙中溶液的酸性
(4)四种金属的活动性由强到弱的顺序是

根据实验现象,回答下列问题:
(1)装置甲中负极的电极反应式为
${A - 2e^{-} = A^{2+}}$
。(2)装置乙中正极的电极反应式为
${Cu^{2+} + 2e^{-} = Cu}$
。(3)装置丙中溶液的酸性
减弱
(填“增强”“减弱”或“不变”)。(4)四种金属的活动性由强到弱的顺序是
D>A>B>C
。
答案:
12.(1)${A - 2e^{-} = A^{2+}}$ (2)${Cu^{2+} + 2e^{-} = Cu}$ (3)减弱 (4)D>A>B>C 解析:甲、乙、丙均为原电池装置。依据原电池原理,甲中A不断溶解,则A为负极、B为正极,金属活动性:A>B;乙中C的质量增大,即析出Cu,则B为负极,金属活动性:B>C;丙中A上有气体产生,即有${H_{2}}$产生,则A为正极,金属活动性:D>A,随着${H^{+}}$的消耗,溶液的酸性减弱。
13. (选做题)(2025·北京朝阳检测)Fe和Mg与H₂SO₄反应的实验记录如表:
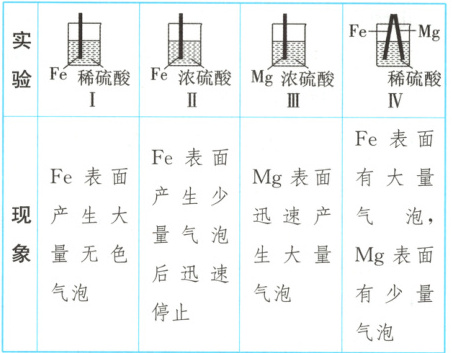
关于上述实验说法不合理的是(
A.Ⅰ中产生气体的原因是Fe + 2H⁺ = Fe²⁺ + H₂↑
B.取出Ⅱ中的铁棒放入CuSO₄溶液,立即析出红色固体
C.取出Ⅲ中的镁棒放入CuSO₄溶液,立即析出红色固体
D.Ⅳ中现象说明Mg的活动性比Fe强

关于上述实验说法不合理的是(
B
)A.Ⅰ中产生气体的原因是Fe + 2H⁺ = Fe²⁺ + H₂↑
B.取出Ⅱ中的铁棒放入CuSO₄溶液,立即析出红色固体
C.取出Ⅲ中的镁棒放入CuSO₄溶液,立即析出红色固体
D.Ⅳ中现象说明Mg的活动性比Fe强
答案:
13.B 解析:实验Ⅰ:铁和稀硫酸反应生成${H_{2}}$,${Fe + 2H^{+} = Fe^{2+} + H_{2}\uparrow}$,因此铁表面产生大量无色气泡,A正确;实验Ⅱ:常温下,铁在浓硫酸中会发生钝化,表面产生一层致密的氧化薄膜,因此取出Ⅱ中的铁棒放入硫酸铜溶液中,不会立即析出红色固体,B错误;实验Ⅲ:镁表面迅速产生大量气泡,说明镁和浓硫酸没有发生钝化反应,取出Ⅲ中的镁棒放入${CuSO_{4}}$溶液,立即析出红色固体Cu,C正确;实验Ⅳ:装置可形成原电池,正极上产生气泡,因此铁作正极,镁作负极,Ⅳ中现象说明Mg的活动性比Fe强,D正确。
查看更多完整答案,请扫码查看


