2025年通成学典课时作业本高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年通成学典课时作业本高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第18页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
11. (2024·江苏徐州期末)下列关于含氮化合物的制备、性质等实验原理及装置、现象正确的是(

A.装置甲可用于制备并干燥${NH_{3}}$
B.装置乙用于制备${NO_{2}}$气体
C.装置丙仅起到安全瓶作用
D.反应一段时间后装置丁中溶液变为蓝色
D
)
A.装置甲可用于制备并干燥${NH_{3}}$
B.装置乙用于制备${NO_{2}}$气体
C.装置丙仅起到安全瓶作用
D.反应一段时间后装置丁中溶液变为蓝色
答案:
11.D 解析:装置甲用于制备并干燥氨,但试管口应略向下倾斜,防止产生的水蒸气冷凝回流炸裂试管,A错误;氨具有还原性,在加热和有催化剂(如铂)的条件下,能够与氧气发生催化氧化生成一氧化氮,则装置乙用于制备一氧化氮气体,B错误;装置丙不仅可以作为安全瓶防止倒吸,还可以收集产生的一氧化氮气体,C错误;一氧化氮在常温下容易与氧气结合生成二氧化氮,二氧化氮在装置丙中与水反应生成稀硝酸,丙中压强增大,将稀硝酸通过导管压入丁中,铜粉与稀硝酸反应生成硝酸铜,溶液呈蓝色,故反应一段时间后装置丁中溶液变为蓝色,D正确。
12. (2024·湖南卷)某学生按图示方法进行实验,观察到以下实验现象:

① 铜丝表面缓慢放出气泡,锥形瓶内气体呈红棕色。
② 铜丝表面气泡释放速度逐渐加快,气体颜色逐渐变深。
③ 一段时间后气体颜色逐渐变浅,至几乎无色。
④ 锥形瓶中液面下降,长颈漏斗中液面上升,最终铜丝与液面脱离接触,反应停止。
下列说法正确的是(
A.开始阶段铜丝表面气泡释放速度缓慢,原因是铜丝在稀硝酸中表面钝化
B.锥形瓶内出现了红棕色气体,表明铜和稀硝酸反应生成了${NO_{2}}$
C.红棕色逐渐变浅的主要原因是${3NO_{2} + H_{2}O\xlongequal{}2HNO_{3} + NO}$
D.铜丝与液面脱离接触,反应停止,原因是硝酸消耗完全

① 铜丝表面缓慢放出气泡,锥形瓶内气体呈红棕色。
② 铜丝表面气泡释放速度逐渐加快,气体颜色逐渐变深。
③ 一段时间后气体颜色逐渐变浅,至几乎无色。
④ 锥形瓶中液面下降,长颈漏斗中液面上升,最终铜丝与液面脱离接触,反应停止。
下列说法正确的是(
C
)A.开始阶段铜丝表面气泡释放速度缓慢,原因是铜丝在稀硝酸中表面钝化
B.锥形瓶内出现了红棕色气体,表明铜和稀硝酸反应生成了${NO_{2}}$
C.红棕色逐渐变浅的主要原因是${3NO_{2} + H_{2}O\xlongequal{}2HNO_{3} + NO}$
D.铜丝与液面脱离接触,反应停止,原因是硝酸消耗完全
答案:
12.C 解析:金属铜在稀硝酸中不会发生钝化,开始阶段气泡释放速度缓慢,可能的原因是铜表面有氧化铜,A错误;由于装置内有空气,铜和稀硝酸反应生成的NO迅速被氧气氧化为红棕色的NO₂,产生的NO₂浓度逐渐增大,气体颜色逐渐变深,B错误;装置内氧气逐渐被消耗,生成的NO₂量逐渐达到最大值,同时装置内的NO₂能与溶液中的H₂O反应:3NO₂+H₂O=2HNO₃+NO,气体颜色变浅,C正确;由于该装置为密闭体系,生成的NO无法排出,逐渐将锥形瓶内液体压入长颈漏斗,铜丝与液面脱离接触,反应停止,D错误。
13. 某兴趣小组设计如图所示的装置来改进教材中“硝酸与铜反应”的实验,以体现化学实验的绿色化。
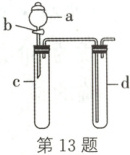
(1)实验前,关闭活塞$b$,试管$d$中加水至浸没长导管口,塞紧试管$c$和$d$的橡胶塞,加热$c$,其目的是
(2)在$d$中加适量$NaOH$溶液,$c$中放一小块铜片,由分液漏斗$a$向$c$中加入$2{mL}$浓硝酸,$c$中反应的化学方程式是
(3)如表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是


(1)实验前,关闭活塞$b$,试管$d$中加水至浸没长导管口,塞紧试管$c$和$d$的橡胶塞,加热$c$,其目的是
检查装置气密性
。(2)在$d$中加适量$NaOH$溶液,$c$中放一小块铜片,由分液漏斗$a$向$c$中加入$2{mL}$浓硝酸,$c$中反应的化学方程式是
Cu+4HNO₃(浓)=Cu(NO₃)₂+2NO₂↑+2H₂O
。再由$a$向$c$中加$2{mL}$蒸馏水,$c$中的实验现象是生成气泡的速率变小,气体颜色变浅
。(3)如表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是
丙
,理由是耗酸量最少,无污染
。
答案:
13.
(1)检查装置气密性
(2)Cu+4HNO₃(浓)=Cu(NO₃)₂+2NO₂↑+2H₂O 生成气泡的速率变小,气体颜色变浅
(3)丙 耗酸量最少,无污染 解析:
(1)加入试剂之前要检查装置气密性。
(2)加入水后,浓硝酸变稀,与Cu反应变缓,产生无色气体NO。
(3)丙方案发生的反应为2Cu+O₂$\xlongequal{\triangle}$2CuO、CuO+2HNO₃=Cu(NO₃)₂+H₂O,无污染性气体生成,且HNO₃只体现酸性,耗酸量少。
(1)检查装置气密性
(2)Cu+4HNO₃(浓)=Cu(NO₃)₂+2NO₂↑+2H₂O 生成气泡的速率变小,气体颜色变浅
(3)丙 耗酸量最少,无污染 解析:
(1)加入试剂之前要检查装置气密性。
(2)加入水后,浓硝酸变稀,与Cu反应变缓,产生无色气体NO。
(3)丙方案发生的反应为2Cu+O₂$\xlongequal{\triangle}$2CuO、CuO+2HNO₃=Cu(NO₃)₂+H₂O,无污染性气体生成,且HNO₃只体现酸性,耗酸量少。
14. (选做题)(2025·四川成都检测)某中学化学兴趣小组用足量的铜与一定量的浓硝酸充分反应,得到$6.72{L}$(标准状况)${NO_{2}}$与$NO$的混合气体,将这些气体与一定体积的${O_{2}}$混合后通入水中,恰好被完全吸收生成硝酸。该兴趣小组又向所得硝酸铜溶液中加入$100{mL}6{mol· L^{-1}}NaOH$溶液,${Cu^{2+}}$恰好沉淀完全。下列说法正确的是(
A.参加反应的${HNO_{3}}$的物质的量为$0.75{mol}$
B.消耗氧气的体积为$6.72{L}$(标准状况)
C.混合气体中含$1.12{L}{NO_{2}}$(标准状况)
D.${O_{2}}$参加反应过程中转移了$0.6{mol}$的电子
D
)A.参加反应的${HNO_{3}}$的物质的量为$0.75{mol}$
B.消耗氧气的体积为$6.72{L}$(标准状况)
C.混合气体中含$1.12{L}{NO_{2}}$(标准状况)
D.${O_{2}}$参加反应过程中转移了$0.6{mol}$的电子
答案:
14.D 解析:足量的铜与浓硝酸先发生反应:Cu+4HNO₃(浓)=Cu(NO₃)₂+2NO₂↑+2H₂O,硝酸浓度逐渐变小,变为稀硝酸时发生反应:3Cu+8HNO₃(稀)=3Cu(NO₃)₂+2NO↑+4H₂O。将所得6.72L(标准状况)NO₂与NO的混合气体与一定体积的O₂混合后通入水中,恰好被完全吸收生成硝酸,则Cu失去的电子的物质的量等于O₂得到的电子的物质的量。同时,100mL6mol·L⁻¹NaOH溶液恰好将所得Cu(NO₃)₂溶液中的Cu²⁺沉淀完全,则NaOH的物质的量也等于Cu失去的电子的物质的量或O₂得到的电子的物质的量。由以上分析可知,参加反应的铜的物质的量为6mol·L⁻¹×0.1L×$\frac{1}{2}$=0.3mol,设6.72L(标准状况)NO₂与NO的混合气体中一氧化氮、二氧化氮的物质的量分别为amol、bmol,由混合气体的体积可得:a+b=0.3,由得失电子守恒可得:3a+b=0.3×2,联立方程可得:a=0.15、b=0.15,由氮元素守恒可知,参加反应的硝酸的物质的量为0.3mol×2+0.15mol+0.15mol=0.9mol,A错误;由得失电子守恒可知,氮的氧化物转化为HNO₃时消耗氧气的物质的量为$\frac{0.15mol×3+0.15mol×1}{4}$=0.15mol,标准状况下的体积为0.15mol×22.4L·mol⁻¹=3.36L,B错误;0.15molNO₂在标准状况下的体积为0.15mol×22.4L·mol⁻¹=3.36L,C错误;O₂参加反应过程中转移电子的物质的量为6mol·L⁻¹×0.1L=0.6mol,D正确。
查看更多完整答案,请扫码查看


