2025年通成学典课时作业本高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年通成学典课时作业本高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第5页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
5. (2025·安徽黄山期中)某溶液中可能含有的阴离子有 $SO^{2-}_{4}$、$CO^{2-}_{3}$、$Cl^{-}$ 等,为了检验其中是否含有 $SO^{2-}_{4}$,除 $BaCl_{2}$ 溶液外,还需要的溶液是 (
A.稀硫酸
B.稀盐酸
C.$NaOH$ 溶液
D.$CaCl_{2}$ 溶液
B
)A.稀硫酸
B.稀盐酸
C.$NaOH$ 溶液
D.$CaCl_{2}$ 溶液
答案:
5.B 解析:硫酸根离子的检验原理:Ba²⁺+SO₄²⁻=BaSO₄↓,先加入稀盐酸酸化,没有沉淀产生,然后加入BaCl₂溶液,产生白色沉淀,则证明有SO₄²⁻,加稀盐酸酸化可以排除CO₃²⁻的干扰,因为BaCO₃是一种不溶于水但能够与稀盐酸反应的白色沉淀,同时还能排除Ag⁺等的干扰。
6. (2025·广东深圳期中)某化学兴趣小组用化学沉淀法去除粗盐中的 $Ca^{2+}$、$Mg^{2+}$ 和 $SO^{2-}_{4}$ 的实验流程如图所示,下列说法错误的是 (

A.试剂 $b$ 为 $Na_{2}CO_{3}$ 溶液
B.滤渣 $c$ 的主要成分为 $Mg(OH)_{2}$、$BaSO_{4}$、
$CaCO_{3}$ 和 $BaCO_{3}$
C.过量稀盐酸的作用是除去过量的 $OH^{-}$ 和 $CO^{2-}_{3}$
D.不考虑实验损耗,含 $1\ mol\ NaCl$ 的粗盐,最终获得的 $NaCl$ 的物质的量为 $1\ mol$
D
)
A.试剂 $b$ 为 $Na_{2}CO_{3}$ 溶液
B.滤渣 $c$ 的主要成分为 $Mg(OH)_{2}$、$BaSO_{4}$、
$CaCO_{3}$ 和 $BaCO_{3}$
C.过量稀盐酸的作用是除去过量的 $OH^{-}$ 和 $CO^{2-}_{3}$
D.不考虑实验损耗,含 $1\ mol\ NaCl$ 的粗盐,最终获得的 $NaCl$ 的物质的量为 $1\ mol$
答案:
6.D 解析:去除粗盐中的Ca²⁺、Mg²⁺和SO₄²⁻的实验流程为将含杂质的粗盐溶解,先加入过量试剂a,然后加入过量BaCl₂溶液,再加入过量试剂b,根据粗盐提纯中Na₂CO₃溶液一定要加在BaCl₂溶液后以除去过量Ba²⁺,可知试剂a为NaOH溶液,试剂b为Na₂CO₃溶液,A正确;杂质离子全部沉淀后过滤,得到含Mg(OH)₂、BaSO₄、BaCO₃、CaCO₃沉淀的滤渣c,B正确;过滤同时得到含NaCl、NaOH、Na₂CO₃的滤液d,加入过量稀盐酸除去过量NaOH、Na₂CO₃后进行蒸发结晶得到精盐,C正确;在粗盐的提纯中,加入的NaOH、BaCl₂、Na₂CO₃、HCl中的Na⁺和Cl⁻最后基本上都转化为NaCl,则含1mol NaCl的粗盐,最终获得的NaCl的物质的量大于1mol,D错误。
7. 在化学课上围绕浓硫酸的
(1)生成的黑色物质(单质)是
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种有刺激性气味的气体是
(3)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液
将(2)中产生的有刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:
化
学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。请回答下列问题:(1)生成的黑色物质(单质)是
C
(填化学式)。(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种有刺激性气味的气体是
SO₂
(填化学式),反应的化学方程式为C+2H₂SO₄(浓$)\triangle=CO₂↑+2SO₂↑+2H₂O$
。(3)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液
褪色
,说明这种气体具有漂白
性;将(2)中产生的有刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:
SO₂+H₂O⇌H₂SO₃
。
答案:
7.
(1)C
(2)SO₂ C+2H₂SO₄(浓$)\triangle=CO₂↑+2SO₂↑+2H₂O (3)$褪色 漂白 SO₂+H₂O⇌H₂SO₃。 解析:
(1)浓硫酸具有脱水性,能使蔗糖炭化,所以生成的黑色物质(单质)是C。
(2)浓硫酸具有强氧化性,能与碳反应生成CO₂、SO₂和水,其中SO₂气体有刺激性气味,是大气的主要污染物之一,该反应的化学方程式为C+2H₂SO₄(浓$)\triangle=CO₂↑+2SO₂↑+2H₂O。$
(3)SO₂具有漂白性,因此将
(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液褪色;SO₂与水反应生成亚硫酸,亚硫酸不稳定,反应的化学方程式为SO₂+H₂O⇌H₂SO₃。
(1)C
(2)SO₂ C+2H₂SO₄(浓$)\triangle=CO₂↑+2SO₂↑+2H₂O (3)$褪色 漂白 SO₂+H₂O⇌H₂SO₃。 解析:
(1)浓硫酸具有脱水性,能使蔗糖炭化,所以生成的黑色物质(单质)是C。
(2)浓硫酸具有强氧化性,能与碳反应生成CO₂、SO₂和水,其中SO₂气体有刺激性气味,是大气的主要污染物之一,该反应的化学方程式为C+2H₂SO₄(浓$)\triangle=CO₂↑+2SO₂↑+2H₂O。$
(3)SO₂具有漂白性,因此将
(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液褪色;SO₂与水反应生成亚硫酸,亚硫酸不稳定,反应的化学方程式为SO₂+H₂O⇌H₂SO₃。
8. (2025·浙江 1 月卷)提纯 $NaCl$ 粗品(含少量的 $Ca^{2+}$、$Mg^{2+}$、$K^{+}$ 和 $SO^{2-}_{4}$)得到 $NaCl$ 纯品的方案如图,所用试剂为 $BaCl_{2}$ 溶液、$Na_{2}CO_{3}$ 溶液、盐酸和 $NaOH$ 溶液。

下列说法不正确的是 (
A.用过量的 $BaCl_{2}$ 溶液除去 $SO^{2-}_{4}$
B.$Ca^{2+}$、$Mg^{2+}$、$SO^{2-}_{4}$ 通过生成沉淀后过滤除去
C.4 种试剂的使用顺序为 $BaCl_{2}$ 溶液、$Na_{2}CO_{3}$ 溶液、盐酸、$NaOH$ 溶液
D.调 $pH$ 后的滤液蒸发至有大量固体析出,趁热过滤、洗涤、干燥后即得 $NaCl$ 纯品

下列说法不正确的是 (
C
)A.用过量的 $BaCl_{2}$ 溶液除去 $SO^{2-}_{4}$
B.$Ca^{2+}$、$Mg^{2+}$、$SO^{2-}_{4}$ 通过生成沉淀后过滤除去
C.4 种试剂的使用顺序为 $BaCl_{2}$ 溶液、$Na_{2}CO_{3}$ 溶液、盐酸、$NaOH$ 溶液
D.调 $pH$ 后的滤液蒸发至有大量固体析出,趁热过滤、洗涤、干燥后即得 $NaCl$ 纯品
答案:
8.C 解析:NaCl粗品溶液中的Ca²⁺用Na₂CO₃溶液除去,Mg²⁺用NaOH溶液除去,SO₄²⁻用BaCl₂溶液除去,且Na₂CO₃溶液要在BaCl₂溶液之后加入,这样还可以除去多余的Ba²⁺,过滤后再加盐酸调节pH,除去多余的Na₂CO₃和NaOH,最后再将滤液蒸发至有大量固体析出,趁热过滤,让K⁺留在母液中,将固体洗涤、干燥后即得NaCl纯品。由以上分析可知,A项、B项、D项正确;盐酸要在过滤后加入,防止生成的沉淀再溶解,C项错误。
9. 对下列事实的解释正确的是 (
A.二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性
B.医疗上可用硫酸钡作钡餐,是因为硫酸钡可以阻挡 X 射线通过且不溶于盐酸
C.向 $50\ mL\ 18\ mol· L^{-1}$ 的 $H_{2}SO_{4}$ 溶液中加入足量的铜片,加热充分反应后,被还原的 $H_{2}SO_{4}$ 的物质的量等于 $0.45\ mol$
D.常温下,浓硫酸可以用铝制容器盛装,说明铝与浓硫酸不反应
B
)A.二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性
B.医疗上可用硫酸钡作钡餐,是因为硫酸钡可以阻挡 X 射线通过且不溶于盐酸
C.向 $50\ mL\ 18\ mol· L^{-1}$ 的 $H_{2}SO_{4}$ 溶液中加入足量的铜片,加热充分反应后,被还原的 $H_{2}SO_{4}$ 的物质的量等于 $0.45\ mol$
D.常温下,浓硫酸可以用铝制容器盛装,说明铝与浓硫酸不反应
答案:
9.B 解析:二氧化硫具有还原性,但不能被浓硫酸氧化,A错误;硫酸钡作X射线透视肠胃的内服药(钡餐)是因为硫酸钡可以阻挡X射线通过且不溶于盐酸,B正确;随着反应的进行,硫酸的浓度降低,稀硫酸不能与铜反应,被还原的H₂SO₄的物质的量小于0.45mol,C错误;常温下浓硫酸使铝钝化(化学变化),形成致密的氧化膜阻碍了反应的继续进行,D错误。
10. 科学探究 实验室探究木炭和浓硫酸在加热条件下反应所得混合气体的成分,下列有关实验装置(部分夹持仪器省略)不能达到实验目的的是 (

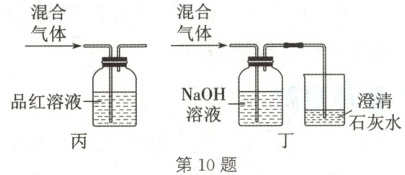
A.用装置甲制得混合气体
B.用装置乙检验混合气体中是否含有 $H_{2}O(g)$
C.用装置丙检验混合气体中是否含有 $SO_{2}$
D.用装置丁检验混合气体中是否含有 $CO_{2}$
D
)

A.用装置甲制得混合气体
B.用装置乙检验混合气体中是否含有 $H_{2}O(g)$
C.用装置丙检验混合气体中是否含有 $SO_{2}$
D.用装置丁检验混合气体中是否含有 $CO_{2}$
答案:
10.D 解析:木炭与浓硫酸在加热条件下发生反应,则用装置甲能制得混合气体,A正确;若混合气体中含有H₂O(g),则无水硫酸铜会由白色变成蓝色,则用装置乙能检验混合气体中是否含有H₂O(g),B正确;SO₂具有漂白性,能使品红溶液褪色,则用装置丙能检验混合气体中是否含有SO₂,C正确;SO₂和CO₂均能被NaOH溶液吸收,澄清石灰水不会出现浑浊,D错误。
查看更多完整答案,请扫码查看


