2025年通成学典课时作业本高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年通成学典课时作业本高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第21页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
11. 证明生石灰中既混有石英,又混有石灰石的正确方法是
(
A.加入过量盐酸,观察是否有气泡冒出
B.加入过量烧碱溶液,观察是否有固体溶解
C.加热至高温,观察是否有气体冒出,是否有硅酸钙生成
D.加入过量盐酸搅拌,观察是否有不溶物剩余及气泡出现
(
D
)A.加入过量盐酸,观察是否有气泡冒出
B.加入过量烧碱溶液,观察是否有固体溶解
C.加热至高温,观察是否有气体冒出,是否有硅酸钙生成
D.加入过量盐酸搅拌,观察是否有不溶物剩余及气泡出现
答案:
11.D 解析:SiO2不溶于除氢氟酸以外的任何酸,CaO、 CaCO3均可溶于盐酸,且CaCO3溶于盐酸有气泡产生。
12. 用$\mathrm{H_2}$还原$\mathrm{SiHCl_3}$(沸点:$32° C$,易与水反应)制备高纯硅的装置如图(尾气处理装置已略去),下列说法错误的是
(
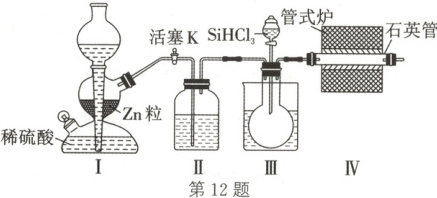
A.装置Ⅰ也可用于实验室制备$\mathrm{CO_2}$
B.装置Ⅱ中盛装浓硫酸,装置Ⅲ的烧杯中盛放高于$32° C$的热水
C.高纯硅可用于制芯片及太阳能电池
D.为鉴定硅中是否含微量铁单质,仅需盐酸和$\mathrm{KSCN}$溶液
(
D
)
A.装置Ⅰ也可用于实验室制备$\mathrm{CO_2}$
B.装置Ⅱ中盛装浓硫酸,装置Ⅲ的烧杯中盛放高于$32° C$的热水
C.高纯硅可用于制芯片及太阳能电池
D.为鉴定硅中是否含微量铁单质,仅需盐酸和$\mathrm{KSCN}$溶液
答案:
12.D 解析:装置Ⅰ是启普发生器,目的是制备氢气,除了 可以制备氢气,还可以使用碳酸钙块状固体和盐酸在启普 发生器中制备二氧化碳,A正确;为确保反应顺利进行,装 置Ⅱ为干燥装置,浓硫酸是常用的干燥剂,除去水蒸气,装 置Ⅲ需水浴加热,目的是使SiHCl3汽化,与氢气充分混合, B正确;高纯硅是良好的半导体材料,可用于制芯片及太阳 能电池,C正确;铁与盐酸反应生成$Fe^{2+},$加入KSCN溶液 不反应,应该加入氧化剂把$Fe^{2+}$氧化为$Fe^{3+},$溶液变红,才 能检验,D错误。
13. (2024·山东临沂期中)硅单质及其化合物应用范围很广。请回答下列问题:
已知:ⅰ. 石英砂的主要成分是$\mathrm{SiO_2}$;
ⅱ. 碳高温的氧化产物是$\mathrm{CO}$。
(1)硅单质可作为半导体材料。三氯硅烷($\mathrm{SiHCl_3}$)还原法是当前制备高纯硅的主要方法,生产过程示意图如图:
①写出由纯$\mathrm{SiHCl_3}$制备高纯硅的化学方程式:
②整个制备过程必须严格控制无水、无氧。$\mathrm{SiHCl_3}$遇水剧烈反应生成$\mathrm{H_2SiO_3}$、$\mathrm{HCl}$和一种气体单质,写出该反应的化学方程式:
(2)下列有关硅材料的说法正确的是
a. 石英坩埚耐高温,可用于加热熔融氢氧化钠
b. 碳化硅硬度大、熔点高,可用于制作高温结构陶瓷和轴承
c. 高纯度的二氧化硅可用于制造高性能通信材料——光导纤维
d. 普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
e. “神舟二十号”飞船所用太阳能电池板可将光能转换为电能,所用转换材料硅也可用于制作电脑芯片
已知:ⅰ. 石英砂的主要成分是$\mathrm{SiO_2}$;
ⅱ. 碳高温的氧化产物是$\mathrm{CO}$。
(1)硅单质可作为半导体材料。三氯硅烷($\mathrm{SiHCl_3}$)还原法是当前制备高纯硅的主要方法,生产过程示意图如图:
①写出由纯$\mathrm{SiHCl_3}$制备高纯硅的化学方程式:
$SiHCl3+H2\xlongequal{1373K}Si+3HCl$
。②整个制备过程必须严格控制无水、无氧。$\mathrm{SiHCl_3}$遇水剧烈反应生成$\mathrm{H_2SiO_3}$、$\mathrm{HCl}$和一种气体单质,写出该反应的化学方程式:
SiHCl3+3H2O=H2SiO3↓+H2↑+3HCl
;在制备高纯硅的过程中若混入$\mathrm{O_2}$可能引起的后果是发生爆炸
。(2)下列有关硅材料的说法正确的是
bce
(填字母)。a. 石英坩埚耐高温,可用于加热熔融氢氧化钠
b. 碳化硅硬度大、熔点高,可用于制作高温结构陶瓷和轴承
c. 高纯度的二氧化硅可用于制造高性能通信材料——光导纤维
d. 普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
e. “神舟二十号”飞船所用太阳能电池板可将光能转换为电能,所用转换材料硅也可用于制作电脑芯片

答案:
13.
(1)①$SiHCl3+H2\xlongequal{1373K}Si+3HCl$ ②SiHCl3+3H2O=H2SiO3↓+H2↑+3HCl 发生爆炸
(2)bce 解析:
(1)①根据图示可知,纯SiHCl3与氢气在1373K的 条件下反应制备高纯硅,该反应的化学方程式为SiHCl3+ H2=1373K Si+3HCl。②SiHCl3和H2O剧烈反应生成 H2SiO3、HCl和一种气体单质,分析已知物质所含元素的 化合价变化可知,硅元素的化合价升高,而H、O、Cl的化合 价均未发生变化,因此气体单质所含元素的化合价必定降 低,则气体单质是H2,SiHCl3遇水剧烈反应生成H2SiO3、 HCl和氢气,该反应的化学方程式为SiHCl3+3H2O=H2SiO3↓+H2↑+3HCl;若混入O2,高温下,H2还原 SiHCl3过程中可能发生爆炸。
(2)石英坩埚耐高温,但二 氧化硅和氢氧化钠反应,不能用于加热熔融氢氧化钠,a错 误;碳化硅硬度大、熔点高、性质稳定,可用于制作高温结构 陶瓷和轴承,b正确;光导纤维的主要成分是二氧化硅,c正 确;普通玻璃无固定的熔点,d错误;硅可用于制作太阳能 电池板和芯片,e正确。
(1)①$SiHCl3+H2\xlongequal{1373K}Si+3HCl$ ②SiHCl3+3H2O=H2SiO3↓+H2↑+3HCl 发生爆炸
(2)bce 解析:
(1)①根据图示可知,纯SiHCl3与氢气在1373K的 条件下反应制备高纯硅,该反应的化学方程式为SiHCl3+ H2=1373K Si+3HCl。②SiHCl3和H2O剧烈反应生成 H2SiO3、HCl和一种气体单质,分析已知物质所含元素的 化合价变化可知,硅元素的化合价升高,而H、O、Cl的化合 价均未发生变化,因此气体单质所含元素的化合价必定降 低,则气体单质是H2,SiHCl3遇水剧烈反应生成H2SiO3、 HCl和氢气,该反应的化学方程式为SiHCl3+3H2O=H2SiO3↓+H2↑+3HCl;若混入O2,高温下,H2还原 SiHCl3过程中可能发生爆炸。
(2)石英坩埚耐高温,但二 氧化硅和氢氧化钠反应,不能用于加热熔融氢氧化钠,a错 误;碳化硅硬度大、熔点高、性质稳定,可用于制作高温结构 陶瓷和轴承,b正确;光导纤维的主要成分是二氧化硅,c正 确;普通玻璃无固定的熔点,d错误;硅可用于制作太阳能 电池板和芯片,e正确。
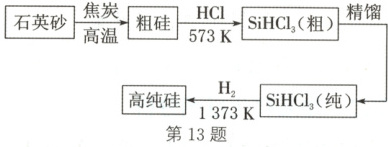
14. (选做题)(2025·广西桂林检测)信息技术离不开芯片,现代芯片离不开高纯度的硅,工业上生产高纯硅的工艺流程如图:

下列说法正确的是
(
A.工业上用焦炭还原石英砂制粗硅的反应应为$\mathrm{SiO_2+C\xlongequal{高温}Si+CO_2}\uparrow$
B.光导纤维的主要成分为高纯硅
C.上述流程②③需在无氧条件下进行
D.上述流程中能循环利用的物质只有$\mathrm{H_2}$

下列说法正确的是
(
C
)A.工业上用焦炭还原石英砂制粗硅的反应应为$\mathrm{SiO_2+C\xlongequal{高温}Si+CO_2}\uparrow$
B.光导纤维的主要成分为高纯硅
C.上述流程②③需在无氧条件下进行
D.上述流程中能循环利用的物质只有$\mathrm{H_2}$
答案:
14.C 解析:制备粗硅的反应为$SiO2+2C\xlongequal{高温}Si+2CO↑, A$错误;光导纤维的主要成分为二氧化硅,B错误;流程② 生成的氢气和流程③消耗的氢气,以及硅和三氯硅烷都能 与氧气反应,所以流程②③需在无氧条件下进行,C正确; 粗硅与氯化氢在300℃条件下发生反应②生成三氯硅烷和 氢气,三氯硅烷与氢气在1100℃条件下发生反应③得到 高纯硅和氯化氢,氢气和氯化氢可以循环利用,D错误。
查看更多完整答案,请扫码查看


