2025年通成学典课时作业本高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年通成学典课时作业本高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第45页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1.(2025·江西赣州检测)关于吸热反应和放热反应,下列说法错误的是(
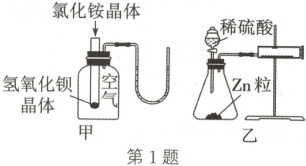
A.用浓氯化铵溶液浸泡舞台幕布,可以起到防火作用,因为氯化铵分解吸收热量
B.反应是放热反应还是吸热反应取决于反应物总键能与生成物总键能的相对大小
C.设计如图装置甲可以判断氢氧化钡晶体与氯化铵晶体的反应是否为吸热反应
D.设计如图装置乙可以判断锌与稀硫酸的反应是否为放热反应
D
)
A.用浓氯化铵溶液浸泡舞台幕布,可以起到防火作用,因为氯化铵分解吸收热量
B.反应是放热反应还是吸热反应取决于反应物总键能与生成物总键能的相对大小
C.设计如图装置甲可以判断氢氧化钡晶体与氯化铵晶体的反应是否为吸热反应
D.设计如图装置乙可以判断锌与稀硫酸的反应是否为放热反应
答案:
1.D 解析:用浓氯化铵溶液浸泡舞台幕布,当发生火灾时,幕布上的氯化铵分解吸收热量,使幕布的温度降低,因此可以起到防火作用,A正确。反应是放热反应还是吸热反应取决于反应物总键能与生成物总键能的相对大小,若反应物总键能大于生成物总键能,则反应吸热;若反应物总键能小于生成物总键能,则反应放热,B正确。反应开始后,甲中U形管左边液面高于右边液面,说明装置内温度降低,反应为吸热反应,C正确。Zn与稀硫酸反应生成氢气,无论反应是否会放出热量,反应产生的氢气都可使注射器活塞向右移动,不能说明相应的化学反应是放热反应,D错误。
2. 一氧化碳是合成一系列 能量基本有机化工产品和中间体的重要原料,下列有关 CO 的说法正确的是(
能量基本有机化工产品和中间体的重要原料,下列有关 CO 的说法正确的是(
A.CO 燃烧的能量变化如图所示
B.C 和$CO_{2}$在高温下生成 CO 的反应是放热反应
C.断裂 CO 和$CO_{2}$中的碳氧键吸收的能量一样多
D.等质量的 C 燃烧生成$CO_{2}$比生成 CO 放出的热量多
 能量基本有机化工产品和中间体的重要原料,下列有关 CO 的说法正确的是(
能量基本有机化工产品和中间体的重要原料,下列有关 CO 的说法正确的是(D
)A.CO 燃烧的能量变化如图所示
B.C 和$CO_{2}$在高温下生成 CO 的反应是放热反应
C.断裂 CO 和$CO_{2}$中的碳氧键吸收的能量一样多
D.等质量的 C 燃烧生成$CO_{2}$比生成 CO 放出的热量多
答案:
2.D 解析:CO燃烧会放出能量,反应物的总能量大于生成物的总能量,A错误;C和CO₂在高温下生成CO的反应是吸热反应,B错误;CO和CO₂中的碳氧键不同,断键吸收的能量不一样多,C错误;等质量的C完全燃烧比不完全燃烧放出的热量多,D正确。
3.(2025·山西太原检测)根据图中信息,下列叙述正确的是(
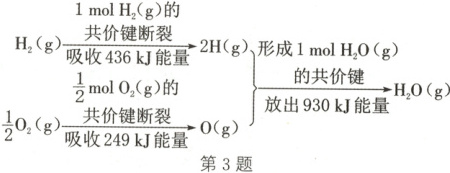
A.$2\ mol\ H_{2}(g)$与$1\ mol\ O_{2}(g)$反应生成$2\ mol\ H_{2}O(g)$放出的能量为$490\ kJ$
B.化学反应中能量变化的大小与反应物的质量多少无关
C.$1\ mol\ H_{2}(g)$与$0.5\ mol\ O_{2}(g)$反应生成$1\ mol\ H_{2}O(l)$释放的能量为$245\ kJ$
D.$2\ mol\ H_{2}O(g)$的能量比$2\ mol\ H_{2}(g)$与$1\ mol\ O_{2}(g)$的能量之和高
A
)
A.$2\ mol\ H_{2}(g)$与$1\ mol\ O_{2}(g)$反应生成$2\ mol\ H_{2}O(g)$放出的能量为$490\ kJ$
B.化学反应中能量变化的大小与反应物的质量多少无关
C.$1\ mol\ H_{2}(g)$与$0.5\ mol\ O_{2}(g)$反应生成$1\ mol\ H_{2}O(l)$释放的能量为$245\ kJ$
D.$2\ mol\ H_{2}O(g)$的能量比$2\ mol\ H_{2}(g)$与$1\ mol\ O_{2}(g)$的能量之和高
答案:
3.A 解析:由图中信息可知,1molH₂(g)与0.5molO₂(g)反应生成1molH₂O(g)放出的能量为930kJ−436kJ−249kJ=245kJ,则2molH₂(g)与1molO₂(g)反应生成2molH₂O(g)放出的能量为490kJ,A正确;化学反应中能量变化的大小与反应物的质量多少有关,B错误;H₂O(g)转化为H₂O(l)还需要释放一部分能量,所以1molH₂(g)与0.5molO₂(g)反应生成1molH₂O(l)放出的能量大于245kJ,C错误;氢气和氧气反应生成水的过程中放热,则2molH₂O(g)的能量比2molH₂(g)与1molO₂(g)的能量之和低,D错误。
4. 某课题组通过数字化实验对白磷燃烧时体系的温度变化进行探究,实验装置及数据曲线如图,其中$t_{3}\ s$时推入$H_{2}O_{2}$溶液。下列说法不正确的是(
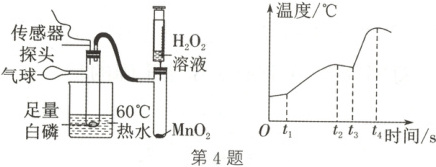
A.$t_{1}\ s$对应的温度是白磷能够燃烧的最低温度
B.$t_{1}~t_{2}\ s$可观察到大量白烟,气球可能膨胀
C.$t_{3}~t_{4}\ s$对应温度升高说明过氧化氢分解放热
D.气球的作用是调节压强,同时使实验更环保
C
)
A.$t_{1}\ s$对应的温度是白磷能够燃烧的最低温度
B.$t_{1}~t_{2}\ s$可观察到大量白烟,气球可能膨胀
C.$t_{3}~t_{4}\ s$对应温度升高说明过氧化氢分解放热
D.气球的作用是调节压强,同时使实验更环保
答案:
4.C 解析:t₁s后温度升高幅度变大,说明t₁s时白磷开始燃烧,则t₁s对应的温度是白磷能够燃烧的最低温度,A正确;t₁~t₂s可观察到大量白烟,白磷燃烧放热,气球可能膨胀,B正确;t₃s时,推入H₂O₂溶液,过氧化氢在二氧化锰的催化下分解生成氧气和水,白磷与O₂接触,继续燃烧,放出大量热,故温度再次升高,C错误;该实验中,白磷燃烧放热,装置内气体受热膨胀,压强增大,故气球的作用是调节压强,防止压强过大导致橡胶塞冲出,同时也可防止反应生成的P₂O₅白烟污染空气,D正确。
5.(2025·安徽黄山期中)将质量相同的纯铜片和纯铁片按如图所示方式插入同浓度的硫酸铜溶液中一段时间,下列说法正确的是(
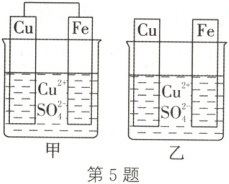
A.甲、乙中铜片均无变化
B.甲中$Cu^{2+}$的消耗速率比乙大
C.甲中每转移$0.1\ mol$电子,理论上铁片与铜片的质量相差$12\ g$
D.乙中每转移$0.1\ mol$电子,理论上铁片与铜片的质量相差$5.6\ g$
B
)
A.甲、乙中铜片均无变化
B.甲中$Cu^{2+}$的消耗速率比乙大
C.甲中每转移$0.1\ mol$电子,理论上铁片与铜片的质量相差$12\ g$
D.乙中每转移$0.1\ mol$电子,理论上铁片与铜片的质量相差$5.6\ g$
答案:
5.B 解析:甲为原电池,铜片为正极,电极反应式为Cu²⁺+2e⁻=Cu,铜片质量增大,A错误;甲为原电池,乙未构成原电池,形成原电池可增大反应速率,所以甲中Cu²⁺的消耗速率比乙大,B正确;甲中铁片质量减小、铜片质量增大,则转移0.1mol电子时,理论上铁片与铜片的质量相差$0.1mol×\frac{1}{2}×56g·mol⁻¹+0.1mol×\frac{1}{2}×64g·mol⁻¹=6g,$C错误;乙中发生反应:Fe+Cu²⁺=Cu+Fe²⁺,每转移2mol电子,溶解的铁片质量为56g,但同时铁片上析出64gCu,则铁片净增8g,由于铜片质量不变,则铁片与铜片质量之差为8g,若转移0.1mol电子,理论上铁片与铜片的质量相差0.4g,D错误。
查看更多完整答案,请扫码查看


