2025年通成学典课时作业本高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年通成学典课时作业本高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第9页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
10. 灼烧绿矾的化学方程式为$2(FeSO_{4}·7H_{2}O)\stackrel{高温}{=\!=\!=}Fe_{2}O_{3} + SO_{2}\uparrow + SO_{3}\uparrow + 14H_{2}O$。将
灼烧绿矾后生成的气体通入如图装置,下
列叙述不正确的是 (
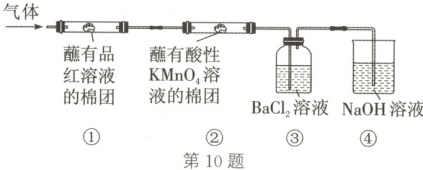
A.①中棉团颜色褪去
B.②中棉团颜色褪去,体现了$SO_{2}$的还
原性
C.③中同时有$BaSO_{3}$和$BaSO_{4}$生成
D.④中可发生反应:$SO_{2} + 2NaOH=\!=\!=Na_{2}SO_{3} + H_{2}O$
灼烧绿矾后生成的气体通入如图装置,下
列叙述不正确的是 (
C
)
A.①中棉团颜色褪去
B.②中棉团颜色褪去,体现了$SO_{2}$的还
原性
C.③中同时有$BaSO_{3}$和$BaSO_{4}$生成
D.④中可发生反应:$SO_{2} + 2NaOH=\!=\!=Na_{2}SO_{3} + H_{2}O$
答案:
10.C 解析:SO₂可使品红溶液褪色,①中棉团颜色褪去,A正确;酸性KMnO₄溶液具有氧化性,能氧化SO₂,②中棉团颜色褪去,体现了SO₂的还原性,B正确;将生成的气体通入BaCl₂溶液中发生反应:SO₃ + H₂O=\!=\!=H₂SO₄、H₂SO₄ + BaCl₂=\!=\!=BaSO₄↓ + 2HCl,由于H₂SO₃的酸性弱于HCl和H₂SO₄,因此SO₂不能与BaCl₂反应,故无BaSO₃生成,C错误;④为吸收尾气(含SO₂)的装置,可发生反应:SO₂ + 2NaOH=\!=\!=Na₂SO₃ + H₂O,D正确。
11. (2024·云南红河期中)氯、硫元素的部分
“价类二维图”如图所示。下列说法正确
的是 (
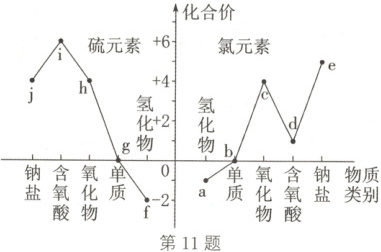
A.$i$与$j$能发生氧化还原反应
B.$d$、$h$的水溶液在空气中久置,溶液的酸
性均减弱
C.$a + e\longrightarrow b$反应的离子方程式为$5Cl^{-} +6H^{+} + ClO_{3}^{-}=\!=\!=3Cl_{2}\uparrow + 3H_{2}O$
D.$Fe$分别与$b$、$g$反应,产物中铁元素的化
合价相同
“价类二维图”如图所示。下列说法正确
的是 (
C
)
A.$i$与$j$能发生氧化还原反应
B.$d$、$h$的水溶液在空气中久置,溶液的酸
性均减弱
C.$a + e\longrightarrow b$反应的离子方程式为$5Cl^{-} +6H^{+} + ClO_{3}^{-}=\!=\!=3Cl_{2}\uparrow + 3H_{2}O$
D.$Fe$分别与$b$、$g$反应,产物中铁元素的化
合价相同
答案:
11.C 解析:i为硫酸,j为亚硫酸钠(或亚硫酸氢钠),二者发生非氧化还原反应,A错误;d为次氯酸,h为二氧化硫,二者的水溶液在空气中久置,HClO见光分解生成HCl,SO₂的水溶液在空气中久置被氧化生成硫酸,则溶液的酸性均增强,B错误;a为氯化氢,e为氯酸钠,b为氯气,氯化氢和氯酸钠反应生成氯气的离子方程式为5Cl⁻ + 6H⁺ + ClO₃⁻=\!=\!=3Cl₂↑ + 3H₂O,C正确;b为氯气,g为硫单质,铁和氯气反应生成FeCl₃,铁和硫反应生成FeS,产物中铁元素的化合价分别为+3、+2,化合价不相同,D错误。
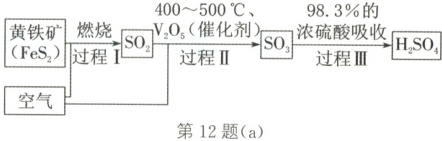
12. (2025·天津静海检测)硫酸是十分重要的
化工原料。工业上用黄铁矿$(FeS_{2})$制备硫
酸的工艺如图(a)。
(1)$FeS_{2}$中硫元素的化合价是
写出过程Ⅰ中发生反应的化学方程式:
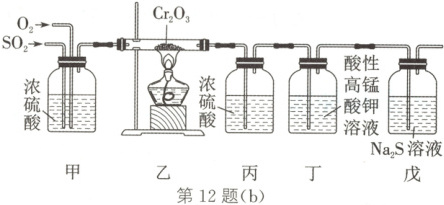
(2)如图(b)是模拟工业过程Ⅱ来探究$SO_{2}$
的催化氧化过程。
① 装置甲的作用是
② 装置丙中盛放的是$18.4\ mol/L$的浓硫
酸,目的是
③ 装置丁的作用是吸收并检验$SO_{2}$已除
尽,现象是酸性高锰酸钾溶液红色变浅,写
出反应的离子方程式:
化工原料。工业上用黄铁矿$(FeS_{2})$制备硫
酸的工艺如图(a)。
(1)$FeS_{2}$中硫元素的化合价是
-1
。写出过程Ⅰ中发生反应的化学方程式:
$4FeS₂ + 11O₂\stackrel{点燃}{=\!=\!=}2Fe₂O₃ + 8SO₂$
。(2)如图(b)是模拟工业过程Ⅱ来探究$SO_{2}$
的催化氧化过程。
① 装置甲的作用是
干燥气体、混合气体、通过观察气泡调节气体混合比例
。② 装置丙中盛放的是$18.4\ mol/L$的浓硫
酸,目的是
吸收SO₃
。③ 装置丁的作用是吸收并检验$SO_{2}$已除
尽,现象是酸性高锰酸钾溶液红色变浅,写
出反应的离子方程式:
5SO₂ + 2MnO₄⁻ + 2H₂O=\!=\!=5SO₄²⁻ + 2Mn²⁺ + 4H⁺
。

答案:
$12.(1)-1 4FeS₂ + 11O₂\stackrel{点燃}{=\!=\!=}2Fe₂O₃ + 8SO₂ (2)①$干燥气体、混合气体、通过观察气泡调节气体混合比例 ②吸收SO₃ ③5SO₂ + 2MnO₄⁻ + 2H₂O=\!=\!=5SO₄²⁻ + 2Mn²⁺ + 4H⁺ 解析:
(1)FeS₂中Fe为+2价,根据化合物中元素正、负化合价代数和为0,可知S元素的化合价为-1。过程Ⅰ中发生反应的化学方程式为$4FeS₂ + 11O₂\stackrel{点燃}{=\!=\!=}2Fe₂O₃ + 8SO₂。$
(2)在模拟工业过程Ⅱ来探究SO₂的催化氧化过程时,装置甲中浓硫酸的作用是干燥气体、混合气体、通过观察气泡调节气体混合比例;在装置乙中SO₂、O₂发生催化氧化反应产生SO₃;装置丙中盛放的是18.4mol/L的浓硫酸,目的是吸收SO₃气体,防止形成酸雾;在装置丁中,用酸性KMnO₄溶液氧化除去未反应的SO₂,该反应的离子方程式为5SO₂ + 2MnO₄⁻ + 2H₂O=\!=\!=5SO₄²⁻ + 2Mn²⁺ + 4H⁺;装置戊中的Na₂S能被O₂氧化,产生黄色的S沉淀而使溶液变浑浊,据此判断SO₂催化氧化时有O₂剩余。
(1)FeS₂中Fe为+2价,根据化合物中元素正、负化合价代数和为0,可知S元素的化合价为-1。过程Ⅰ中发生反应的化学方程式为$4FeS₂ + 11O₂\stackrel{点燃}{=\!=\!=}2Fe₂O₃ + 8SO₂。$
(2)在模拟工业过程Ⅱ来探究SO₂的催化氧化过程时,装置甲中浓硫酸的作用是干燥气体、混合气体、通过观察气泡调节气体混合比例;在装置乙中SO₂、O₂发生催化氧化反应产生SO₃;装置丙中盛放的是18.4mol/L的浓硫酸,目的是吸收SO₃气体,防止形成酸雾;在装置丁中,用酸性KMnO₄溶液氧化除去未反应的SO₂,该反应的离子方程式为5SO₂ + 2MnO₄⁻ + 2H₂O=\!=\!=5SO₄²⁻ + 2Mn²⁺ + 4H⁺;装置戊中的Na₂S能被O₂氧化,产生黄色的S沉淀而使溶液变浑浊,据此判断SO₂催化氧化时有O₂剩余。
13. (选做题)(2024·辽宁锦州期末)标准状况
下,将$a\ L\ SO_{2}$和$Cl_{2}$组成的混合气体通入
$100\ mL\ 0.1\ mol/L\ Fe_{2}(SO_{4})_{3}$溶液中,充分
反应后(气体被充分吸收且无剩余),溶液
的棕黄色变浅。向反应后的溶液中加入足
量的$BaCl_{2}$溶液,将所得沉淀过滤、洗涤、干
燥后称重,其质量为$9.32\ g$。下列关于该过
程的推断正确的是 (
A.所得沉淀为$BaSO_{3}$和$BaSO_{4}$的混合物
B.混合气体中$Cl_{2}$的体积可能为$0.3\ L$
C.$a$的取值范围为$0.224 < a < 0.448$
D.混合气体中$SO_{2}$的体积无法确定
下,将$a\ L\ SO_{2}$和$Cl_{2}$组成的混合气体通入
$100\ mL\ 0.1\ mol/L\ Fe_{2}(SO_{4})_{3}$溶液中,充分
反应后(气体被充分吸收且无剩余),溶液
的棕黄色变浅。向反应后的溶液中加入足
量的$BaCl_{2}$溶液,将所得沉淀过滤、洗涤、干
燥后称重,其质量为$9.32\ g$。下列关于该过
程的推断正确的是 (
C
)A.所得沉淀为$BaSO_{3}$和$BaSO_{4}$的混合物
B.混合气体中$Cl_{2}$的体积可能为$0.3\ L$
C.$a$的取值范围为$0.224 < a < 0.448$
D.混合气体中$SO_{2}$的体积无法确定
答案:
13.C 解析:将SO₂和Cl₂组成的混合气体通入Fe₂(SO₄)₃溶液中,由于氯气的氧化性强于铁离子,故氯气先与二氧化硫反应:SO₂ + Cl₂ + 2H₂O=\!=\!=2HCl + H₂SO₄,充分反应后,溶液的棕黄色变浅,说明铁离子氧化二氧化硫,发生反应:2Fe³⁺ + SO₂ + 2H₂O=\!=\!=SO₄²⁻ + 2Fe²⁺ + 4H⁺,二氧化硫完全反应,向反应后的溶液中加入足量的BaCl₂溶液,生成的9.32g沉淀为BaSO₄,其物质的量为$\frac{9.32g}{233g/mol}=0.04mol,$根据硫元素守恒可知,n(BaSO₄)=3n[Fe₂(SO₄)₃] + n(SO₂),n(SO₂)=0.04mol - 0.1mol/L×0.1L×3=0.01mol。由以上分析可知,所得沉淀为BaSO₄,A错误;由于硫酸铁氧化了部分SO₂,根据化学方程式SO₂ + Cl₂ + 2H₂O=\!=\!=2HCl + H₂SO₄可知,n(Cl₂)<n(SO₂)=0.01mol,故Cl₂的体积最大接近0.01mol×22.4L/mol=0.224L,B错误;由于n(SO₂)=0.01mol,SO₂的体积为0.224L,n(Cl₂)<n(SO₂)=0.01mol,Cl₂的体积最大接近0.224L,a的取值范围为0.224<a<0.448,C正确、D错误。
查看更多完整答案,请扫码查看


