2025年通成学典课时作业本高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年通成学典课时作业本高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第41页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
6. (2025·湖北武汉期中)某同学用足量的锌粉分别与 $100\ mL\ 0.1\ mol·L^{-1}$ 和 $50\ mL\ 0.2\ mol·L^{-1}$ 的稀硫酸反应,记录相关数据,并作出两个反应过程中放出气体的体积随反应时间的变化如图所示,忽略反应过程中溶液的体积变化。下列叙述错误的是 (
A.曲线Ⅰ表示 $0.2\ mol·L^{-1}$ 的稀硫酸与足量的锌粉反应
B.$0$~$t_2\ min$,曲线Ⅱ中用 $H^+$ 的浓度变化表示的反应速率 $v(H^+)=\frac{0.2}{t_2}\ mol·L^{-1}·min^{-1}$
C.若向曲线Ⅰ、Ⅱ对应的稀硫酸中均加少量硫酸铜固体,$t_1$ 和 $t_2$ 均减小,且 V 均减小
D.若向曲线Ⅰ、Ⅱ对应的稀硫酸中均加 5 滴浓硫酸,反应速率均增大,且 V 均增大
C
)
A.曲线Ⅰ表示 $0.2\ mol·L^{-1}$ 的稀硫酸与足量的锌粉反应
B.$0$~$t_2\ min$,曲线Ⅱ中用 $H^+$ 的浓度变化表示的反应速率 $v(H^+)=\frac{0.2}{t_2}\ mol·L^{-1}·min^{-1}$
C.若向曲线Ⅰ、Ⅱ对应的稀硫酸中均加少量硫酸铜固体,$t_1$ 和 $t_2$ 均减小,且 V 均减小
D.若向曲线Ⅰ、Ⅱ对应的稀硫酸中均加 5 滴浓硫酸,反应速率均增大,且 V 均增大
答案:
6.C 解析:酸中氢离子浓度越大,反应速率越大,曲线越陡,则曲线I表示0.2mol·L⁻¹的稀硫酸与足量的锌粉反应,A正确;0~t₂min内,100mL0.1mol·L⁻¹的稀硫酸完全反应,Δc(H⁺)=0.2mol·L⁻¹,曲线II中用H⁺的浓度变化表示的反应速率$v(H⁺)=\frac{\Delta c(H⁺)}{\Delta t}=\frac{0.2mol·L⁻¹}{t₂min}=\frac{0.2}{t₂}mol·L⁻¹·min⁻¹,$B正确;若向曲线I、II对应的稀硫酸中均加少量硫酸铜固体,锌和硫酸铜反应生成铜单质,形成Cu-Zn原电池,增大反应速率,则t₁和t₂均减小,由于锌粉足量,因此V不变,C错误;若向曲线I、II对应的稀硫酸中均加5滴浓硫酸,H⁺浓度变大,反应速率均增大,由于锌粉足量,所以生成氢气的体积增大,D正确。
7. 某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可以增大氢气的生成速率。请回答下列问题:
(1) 加入少量硫酸铜溶液可以增大氢气的生成速率的原因是
(2) 为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入 6 个盛有过量 $Zn$ 粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
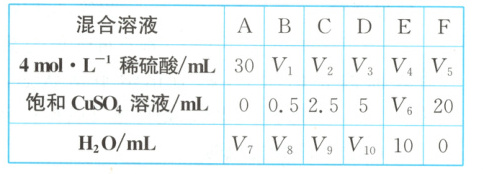
① 请完成此实验设计,其中$V_1$ =
$V_6$ =
② 该同学最后得出的结论为当加入少量 $CuSO_4$ 溶液时,生成氢气的速率会大大提高,但当加入的 $CuSO_4$ 溶液超过一定量时,生成氢气的速率反而会下降。请分析生成氢气的速率下降的主要原因:
(1) 加入少量硫酸铜溶液可以增大氢气的生成速率的原因是
CuSO₄与Zn反应产生的Cu和Zn以及稀硫酸形成原电池,增大了氢气的生成速率
。(2) 为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入 6 个盛有过量 $Zn$ 粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。

① 请完成此实验设计,其中$V_1$ =
30
,$V_6$ =
10
,$V_9$ = 17.5
。② 该同学最后得出的结论为当加入少量 $CuSO_4$ 溶液时,生成氢气的速率会大大提高,但当加入的 $CuSO_4$ 溶液超过一定量时,生成氢气的速率反而会下降。请分析生成氢气的速率下降的主要原因:
当加入的CuSO₄溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,减小了Zn与稀硫酸的接触面积
。
答案:
7.
(1)CuSO₄与Zn反应产生的Cu和Zn以及稀硫酸形成原电池,增大了氢气的生成速率
(2)①30 10 17.5
②当加入的CuSO₄溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,减小了Zn与稀硫酸的接触面积
解析:
(2)①因为要研究CuSO₄的量对氢气生成速率的影响,所以应保持硫酸溶液的浓度在各组实验中相同,则稀硫酸的体积均取30mL,即V₁=30,根据混合溶液F中加入的水与硫酸铜溶液的体积之和为20mL,可以求得V₆=10,V₇=20,V₈=19.5,V₉=17.5,V₁₀=15。
(1)CuSO₄与Zn反应产生的Cu和Zn以及稀硫酸形成原电池,增大了氢气的生成速率
(2)①30 10 17.5
②当加入的CuSO₄溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,减小了Zn与稀硫酸的接触面积
解析:
(2)①因为要研究CuSO₄的量对氢气生成速率的影响,所以应保持硫酸溶液的浓度在各组实验中相同,则稀硫酸的体积均取30mL,即V₁=30,根据混合溶液F中加入的水与硫酸铜溶液的体积之和为20mL,可以求得V₆=10,V₇=20,V₈=19.5,V₉=17.5,V₁₀=15。
8. (选做题)某课外兴趣小组探究影响化学反应速率的因素,下列说法不正确的是 (
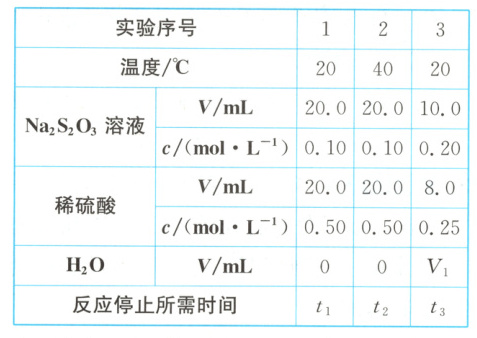
A.实验 1 中,若 $t_1$ 为 $1\ min$,则 $v(S_2O_3^{2-}) = 0.1\ mol·L^{-1}·min^{-1}$
B.不能通过观察气泡生成的快慢比较反应速率
C.实验 1 和 2 可探究温度对反应速率的影响,实验结果应为 $t_1>t_2$
D.若用实验 1 和 3 探究硫酸浓度对反应速率的影响,则 $V_1 = 22.0$
A
)
A.实验 1 中,若 $t_1$ 为 $1\ min$,则 $v(S_2O_3^{2-}) = 0.1\ mol·L^{-1}·min^{-1}$
B.不能通过观察气泡生成的快慢比较反应速率
C.实验 1 和 2 可探究温度对反应速率的影响,实验结果应为 $t_1>t_2$
D.若用实验 1 和 3 探究硫酸浓度对反应速率的影响,则 $V_1 = 22.0$
答案:
8.A 解析:实验发生反应的化学方程式为Na₂S₂O₃+H₂SO₄=Na₂SO₄+SO₂↑+S↓+H₂O。实验1中,溶液总体积为20.0mL+20.0mL=40.0mL,稀硫酸过量,硫代硫酸钠完全反应,所以$v(S₂O₃²⁻)=\frac{(20.0×10⁻³)L×0.10mol·L⁻¹}{(40.0×10⁻³)L×1min}=0.05mol·L⁻¹·min⁻¹,$A错误;虽然反应生成气体,但是气体在不同温度时的溶解度不同,不能通过观察气泡生成的快慢比较反应速率,B正确;比较实验1、2的数据,两组实验只有温度不同,温度越高,反应速率越大,反应停止所需时间越短,则实验结果应为t₁>t₂,C正确;根据实验1、2可知,实验3需保持溶液总体积为40.0mL,则V₁=40.0-10.0-8.0=22.0,D正确。
查看更多完整答案,请扫码查看


