2025年通成学典课时作业本高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年通成学典课时作业本高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第15页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
13. 模型认知 如图所示是氮元素的常见化合价与部分含氮物质的对应关系图(价类二维图),下列说法正确的是(
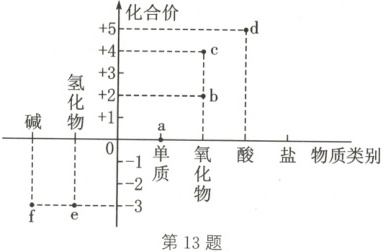
A.$a$可作保护气,在任何条件下均不与其他物质反应
B.$c$与水反应可生成$b$和$d$,该反应中$c$只作氧化剂
C.存在$e\rightarrow b\rightarrow c\rightarrow d$的转化
D.$f$是一种强碱
C
)
A.$a$可作保护气,在任何条件下均不与其他物质反应
B.$c$与水反应可生成$b$和$d$,该反应中$c$只作氧化剂
C.存在$e\rightarrow b\rightarrow c\rightarrow d$的转化
D.$f$是一种强碱
答案:
13.C 解析:结合“价类二维图”可知,a为 $ N_2$,b为 $ NO$,c为 $ NO_2$,d为 $ HNO_3$,e为 $ NH_3$,f为 $ NH_3 · H_2 O$。$ N_2$ 性质稳定,可作保护气,但在一定条件下也能与氧气、氢气等发生反应,A错误;c是 $ NO_2$,与水反应生成 $ HNO_3$ 和 $ NO$:$3 NO_2+ H_2 O \longrightarrow 2 HNO_3+ NO$,根据化合价的变化情况分析,$ NO_2$ 既作氧化剂,又作还原剂,B错误;氮的化合物中,可实现 $ NH_3 \overset{ O_2}{\longrightarrow} NO \overset{ O_2}{\longrightarrow} NO_2 \overset{ H_2 O}{\longrightarrow} HNO_3$ 的转化,C正确;f是 $ NH_3 · H_2 O$,在水溶液中发生部分电离,是弱碱,D错误。
14. 用一充满氨的烧瓶做喷泉实验,当水充满整个烧瓶后,烧瓶内的氨水中溶质的物质的量浓度约是(按标准状况计算)(
A.$0.045\ mol· L^{-1}$
B.$1\ mol· L^{-1}$
C.$0.029\ mol· L^{-1}$
D.不能确定
A
)A.$0.045\ mol· L^{-1}$
B.$1\ mol· L^{-1}$
C.$0.029\ mol· L^{-1}$
D.不能确定
答案:
14.A 解析:本题以氨的喷泉实验为切入点考查物质的量的有关计算。假设烧瓶的容积为 $1\ L$,则氨的物质的量为 $\frac{1\ L}{22.4\ L · mol^{-1}}=\frac{1}{22.4}\ mol$,溶液的体积为 $1\ L$,氨水中溶质的物质的量浓度为 $\frac{1}{22.4}\ mol · L^{-1}$,约为 $0.045\ mol · L^{-1}$。
15. (2025·广东东莞期中)氮元素是植物不可缺少的一种主要营养元素。游离态的$ N_{2}$不能被大多数植物直接吸收,植物吸收和利用效果最好的是$ NH_{4}^{+}$和$ NO_{3}^{-}$。回答下列问题:
(1)氮的固定包含人工固氮和
(2)豆科植物的根瘤菌能把空气中的$ N_{2}$转化为$ NH_{3}$,此过程可简单地用化学方程式表示为
(3)$ NH_{3}$的催化氧化是工业制硝酸的基础,写出氨的催化氧化的化学方程式:
(4)碳酸氢铵作肥料时,要遵循“五不施”原则,其中有“烈日当空不施”,原因是
(5)自然界中的微生物也可将氮的化合态$ NH_{3}$转化为游离态的$ N_{2}$,在实验室可用$ Cl_{2}$实现此过程。如图所示,试管中集满干燥的
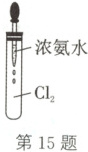
$ Cl_{2}$,迅速用橡胶塞塞紧,滴入足量浓氨水。开始时,试管内发生反应:$2 NH_{3} + 3 Cl_{2}\longrightarrow N_{2} + 6 HCl$,并产生白烟,白烟的化学式为
(1)氮的固定包含人工固氮和
自然固氮
;人工固氮中工业合成氨的化学方程式为$ N_2+3 H_2 \underset{\triangle}{\overset{ 高温、高压}{\rightleftharpoons}} 催化剂 2 NH_3$
。(2)豆科植物的根瘤菌能把空气中的$ N_{2}$转化为$ NH_{3}$,此过程可简单地用化学方程式表示为
2
$ N_{2} +$3
$ C +$6
$ H_{2} O\stackrel{ 根瘤菌}{=}$4
$ NH_{3} +$3
$ CO_{2}$。(配平化学方程式)(3)$ NH_{3}$的催化氧化是工业制硝酸的基础,写出氨的催化氧化的化学方程式:
$4 NH_3+5 O_2 \underset{\triangle}{\overset{ 催化剂}{\rightleftharpoons}} 4 NO+6 H_2 O$
。(4)碳酸氢铵作肥料时,要遵循“五不施”原则,其中有“烈日当空不施”,原因是
$ NH_4 HCO_3 \overset{\triangle}{\rightleftharpoons} NH_3 \uparrow+ H_2 O+ CO_2 \uparrow$
(用化学方程式表示)。(5)自然界中的微生物也可将氮的化合态$ NH_{3}$转化为游离态的$ N_{2}$,在实验室可用$ Cl_{2}$实现此过程。如图所示,试管中集满干燥的

$ Cl_{2}$,迅速用橡胶塞塞紧,滴入足量浓氨水。开始时,试管内发生反应:$2 NH_{3} + 3 Cl_{2}\longrightarrow N_{2} + 6 HCl$,并产生白烟,白烟的化学式为
$ NH_4 Cl$
;将反应后的试管浸入水中并倒立,在水下打开橡胶塞,最终进入试管内的水约占试管总体积的$\frac{2}{3}$
。
答案:
15.(1)自然固氮 $ N_2+3 H_2 \underset{\triangle}{\overset{ 高温、高压}{\rightleftharpoons}} 催化剂 2 NH_3$ (2)$\frac{2}{3}$ $\frac{6}{4}$ $\frac{4}{3}$ (3)$4 NH_3+5 O_2 \underset{\triangle}{\overset{ 催化剂}{\rightleftharpoons}} 4 NO+6 H_2 O$
(4)$ NH_4 HCO_3 \overset{\triangle}{\rightleftharpoons} NH_3 \uparrow+ H_2 O+ CO_2 \uparrow$ (5)$ NH_4 Cl \overset{\frac{2}{3}}{\rightleftharpoons}$
解析:(1)氮的固定是将游离态的氮转化为化合态的氮,固氮方式有自然固氮、人工固氮;人工固氮中工业合成氨的化学方程式为 $ N_2+3 H_2 \underset{\triangle}{\overset{ 高温、高压}{\rightleftharpoons}} 催化剂 2 NH_3$。(2)豆科植物的根瘤菌能把空气中的 $ N_2$ 转化为 $ NH_3$,此过程可简单地用化学方程式表示为 $2 N_2+3 C+6 H_2 O \overset{ 根瘤菌}{\rightleftharpoons} 4 NH_3+3 CO_2$。(3)氨催化氧化生成一氧化氮和水,反应的化学方程式为 $4 NH_3+5 O_2 \underset{\triangle}{\overset{ 催化剂}{\rightleftharpoons}} 4 NO+6 H_2 O$。(4)碳酸氢铵不稳定,受热易分解,发生反应:$ NH_4 HCO_3 \overset{\triangle}{\rightleftharpoons} NH_3 \uparrow+ H_2 O+ CO_2 \uparrow$。(5)试管内发生反应:$2 NH_3+3 Cl_2 \longrightarrow N_2+6 HCl$,生成的氯化氢和氨发生化合反应生成白色的氯化铵,产生了白烟,白烟的化学式为 $ NH_4 Cl$;由反应的化学方程式可知生成的 $ N_2$ 的物质的量是参加反应的 $ Cl_2$ 的物质的量的 $\frac{1}{3}$,因此进入试管内的水约占试管总体积的 $\frac{2}{3}$。
(4)$ NH_4 HCO_3 \overset{\triangle}{\rightleftharpoons} NH_3 \uparrow+ H_2 O+ CO_2 \uparrow$ (5)$ NH_4 Cl \overset{\frac{2}{3}}{\rightleftharpoons}$
解析:(1)氮的固定是将游离态的氮转化为化合态的氮,固氮方式有自然固氮、人工固氮;人工固氮中工业合成氨的化学方程式为 $ N_2+3 H_2 \underset{\triangle}{\overset{ 高温、高压}{\rightleftharpoons}} 催化剂 2 NH_3$。(2)豆科植物的根瘤菌能把空气中的 $ N_2$ 转化为 $ NH_3$,此过程可简单地用化学方程式表示为 $2 N_2+3 C+6 H_2 O \overset{ 根瘤菌}{\rightleftharpoons} 4 NH_3+3 CO_2$。(3)氨催化氧化生成一氧化氮和水,反应的化学方程式为 $4 NH_3+5 O_2 \underset{\triangle}{\overset{ 催化剂}{\rightleftharpoons}} 4 NO+6 H_2 O$。(4)碳酸氢铵不稳定,受热易分解,发生反应:$ NH_4 HCO_3 \overset{\triangle}{\rightleftharpoons} NH_3 \uparrow+ H_2 O+ CO_2 \uparrow$。(5)试管内发生反应:$2 NH_3+3 Cl_2 \longrightarrow N_2+6 HCl$,生成的氯化氢和氨发生化合反应生成白色的氯化铵,产生了白烟,白烟的化学式为 $ NH_4 Cl$;由反应的化学方程式可知生成的 $ N_2$ 的物质的量是参加反应的 $ Cl_2$ 的物质的量的 $\frac{1}{3}$,因此进入试管内的水约占试管总体积的 $\frac{2}{3}$。
查看更多完整答案,请扫码查看


