2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15. (16 分)$CO$ 是重要的化工原料,合理使用 $CO$ 能发挥其在工业生产、物质合成、速率分析等领域的重要作用。回答下列问题:
(1)已知下列反应的热化学方程式:
①$C(s)+\frac{1}{2}O_{2}(g)\xlongequal{}CO(g)$ $\Delta H_{1}=-111\ kJ· mol^{-1}$
②$C(s)+O_{2}(g)\xlongequal{}CO_{2}(g)$ $\Delta H_{2}=-394\ kJ· mol^{-1}$
计算 $CO$ 燃烧生成 $CO_{2}$ 反应③$CO(g)+\frac{1}{2}O_{2}(g)\xlongequal{}CO_{2}(g)$ 的 $\Delta H_{3}=$
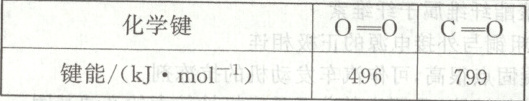
(2)已知下列键能数据,结合反应③数据,计算 $C\equiv O$ 的键能是
(3)$650\ K$ 时,某研究小组测得反应 $i:CO(g)+NO_{2}(g)\xlongequal{}CO_{2}(g)+NO(g)$ 的浓度、速率数据如下:
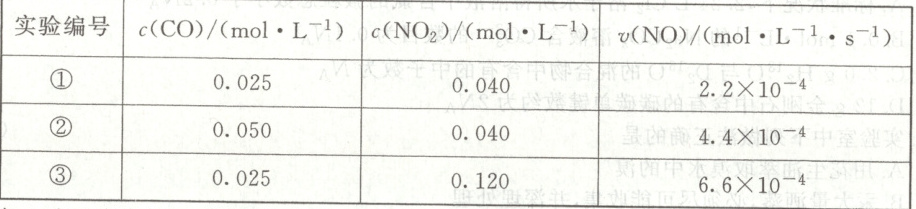
已知 $k$ 为速率常数,一般情况下只与温度有关,实验测得 $v(NO)=k· c^{m}(CO)· c^{n}(NO_{2})$,通过以上实验数据可知 $m=$
(4)在上述实验过程中,同时发生了如下副反应 $ii:4CO(g)+2NO_{2}(g)\xlongequal{}4CO_{2}(g)+N_{2}(g)$,$650\ K$ 时,向容积为 $2\ L$ 的密闭容器中通入 $2\ mol\ CO$ 和 $2\ mol\ NO_{2}$,$10\ min$ 后体系达到平衡,此时 $CO_{2}、NO_{2}$ 的物质的量分别为 $1.8\ mol、0.3\ mol$,反应 $i$ 的平衡常数为
(5)已知 $CO$ 是常见配体,配位时简单认为 1 个 $CO$ 提供 2 个电子,EAN 规则认为金属的价电子数加上配体提供的电子数等于 18 时,配位化合物一般较稳定,下列结构能够稳定存在的有
A. $[Mn(CO)_{5}]$
B. $[Cr(CO)_{5}]$
C. $[Co(CO)_{4}]$
D. $[Ni(CO)_{4}]$
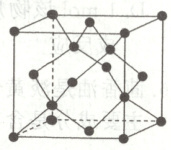
(6)$CO$ 可以用于生产多晶金刚石箔,将一氧化碳和氢气混合,在高温高压下通过催化剂使之沉积在金属基底上,形成金刚石晶体。金刚石的晶胞如图,晶胞参数为 $b\ nm$,晶胞中 $C$ 与 $C$ 间的最大距离为
(1)已知下列反应的热化学方程式:
①$C(s)+\frac{1}{2}O_{2}(g)\xlongequal{}CO(g)$ $\Delta H_{1}=-111\ kJ· mol^{-1}$
②$C(s)+O_{2}(g)\xlongequal{}CO_{2}(g)$ $\Delta H_{2}=-394\ kJ· mol^{-1}$
计算 $CO$ 燃烧生成 $CO_{2}$ 反应③$CO(g)+\frac{1}{2}O_{2}(g)\xlongequal{}CO_{2}(g)$ 的 $\Delta H_{3}=$
-283
$kJ· mol^{-1}$。(2)已知下列键能数据,结合反应③数据,计算 $C\equiv O$ 的键能是
1067
$kJ· mol^{-1}$。
(3)$650\ K$ 时,某研究小组测得反应 $i:CO(g)+NO_{2}(g)\xlongequal{}CO_{2}(g)+NO(g)$ 的浓度、速率数据如下:
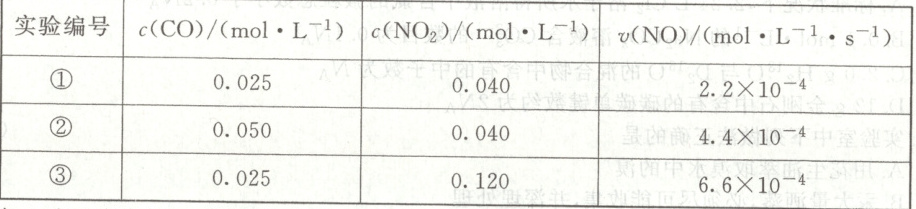
已知 $k$ 为速率常数,一般情况下只与温度有关,实验测得 $v(NO)=k· c^{m}(CO)· c^{n}(NO_{2})$,通过以上实验数据可知 $m=$
1
,$n=$1
;$650\ K$ 时,若 $c(CO)=0.10\ mol· L^{-1}$,$c(NO_{2})=0.16\ mol· L^{-1}$,$v(NO)=$$3.52×10^{-3}$
$mol· L^{-1}· s^{-1}$。(4)在上述实验过程中,同时发生了如下副反应 $ii:4CO(g)+2NO_{2}(g)\xlongequal{}4CO_{2}(g)+N_{2}(g)$,$650\ K$ 时,向容积为 $2\ L$ 的密闭容器中通入 $2\ mol\ CO$ 和 $2\ mol\ NO_{2}$,$10\ min$ 后体系达到平衡,此时 $CO_{2}、NO_{2}$ 的物质的量分别为 $1.8\ mol、0.3\ mol$,反应 $i$ 的平衡常数为
48
。(5)已知 $CO$ 是常见配体,配位时简单认为 1 个 $CO$ 提供 2 个电子,EAN 规则认为金属的价电子数加上配体提供的电子数等于 18 时,配位化合物一般较稳定,下列结构能够稳定存在的有
D
(填字母)。A. $[Mn(CO)_{5}]$
B. $[Cr(CO)_{5}]$
C. $[Co(CO)_{4}]$
D. $[Ni(CO)_{4}]$
(6)$CO$ 可以用于生产多晶金刚石箔,将一氧化碳和氢气混合,在高温高压下通过催化剂使之沉积在金属基底上,形成金刚石晶体。金刚石的晶胞如图,晶胞参数为 $b\ nm$,晶胞中 $C$ 与 $C$ 间的最大距离为
$\sqrt{3}b$
$nm$,晶体密度为$\frac{8×12}{10^{-21}b^{3}N_{A}}$
$g· cm^{-3}$(列出计算式,阿伏加德罗常数的值为 $N_{A}$)。
答案:
15. 解析
(1)由盖斯定律可知,反应②-①得到反应③,则$ΔH_{3}=(-394 kJ·mol^{-1})-(-111 kJ·mol^{-1})=-283 kJ·mol^{-1}。$
(2)由反应热=反应物键能之和-生成物键能之和可得$:ΔH_{3}=E(C≡O)+496 kJ·mol^{-1}×1/2-799 kJ·mol^{-1}×2=-283 kJ·mol^{-1},$解得$E(C≡O)=1 067 kJ·mol^{-1}。$
(3)由①②数据可得$:(0.025/0.050)^{m}=2.2×10^{-4}/4.4×10^{-4},$解得m=1,由①③数据可得$:(0.040/0.120)^{n}=2.2×10^{-4}/6.6×10^{-4},$解得n=1,由①中数据可得反应速率常数$k=2.2×10^{-4}/(0.025×0.040) L·mol^{-1}·s^{-1}=0.22 L·mol^{-1}·s^{-1},$则650 K时,初始一氧化碳浓度为$0.100 mol·L^{-1}、$二氧化氮浓度为$0.160 mol·L^{-1}$时,一氧化氮的反应速率为$0.22 L·mol^{-1}·s^{-1}×0.100 mol·L^{-1}×0.160 mol·L^{-1}=3.52×10^{-3} mol·L^{-1}·s^{-1}。$
(4)设平衡时反应ⅰ生成一氧化氮的浓度为a mol、反应ⅱ生成氮气物质的量为b mol,由题意可建立如下三段式$: CO(g)+NO_{2}(g)⇌CO_{2}(g)+NO(g) $起始/mol 2 2 0 0 转化/mol a a a a 平衡$/mol 2-a 2-a a a 4CO(g)+2NO_{2}(g)⇌4CO_{2}(g)+N_{2}(g) $起始/mol 2-a 2-a a 0 转化/mol 4b 2b 4b b 平衡/mol 2-a-4b 2-a-2b a+4b b 由二氧化氮和二氧化碳的物质的量可得:①2-a-2b=0.3,②a+4b=1.8,解得a=1.6、b=0.05,则反应ⅰ的平衡常数为(1.8/2×1.6/2)/(0.2/2×0.3/2)=48。
(5)由化学式可知,五羰基合锰的价电子数为17、五羰基合铬的价电子数为16、四羰基合钴的价电子数为17、四羰基合镍的价电子数为18,则由题意可知,四羰基合镍能够稳定存在。
(6)由晶胞结构可知,晶胞中碳原子与碳原子的最大距离为体对角线,则距离为√3b nm;晶胞中位于顶点、面心、体内的碳原子个数为8×1/8+6×1/2+4=8,设晶体的密度为$d g/cm^{3},$由晶胞的质量公式可得$:8×12/N_{A}=(10^{-7}b)^{3}d,$解得$d=8×12/(10^{-21}b^{3}N_{A})。$ 答案$ (1)-283 (2)1067 (3)1 1 3.52×10^{-3} (4)48 (5)D (6)√3b 8×12/(10^{-21}b^{3}N_{A})$
(1)由盖斯定律可知,反应②-①得到反应③,则$ΔH_{3}=(-394 kJ·mol^{-1})-(-111 kJ·mol^{-1})=-283 kJ·mol^{-1}。$
(2)由反应热=反应物键能之和-生成物键能之和可得$:ΔH_{3}=E(C≡O)+496 kJ·mol^{-1}×1/2-799 kJ·mol^{-1}×2=-283 kJ·mol^{-1},$解得$E(C≡O)=1 067 kJ·mol^{-1}。$
(3)由①②数据可得$:(0.025/0.050)^{m}=2.2×10^{-4}/4.4×10^{-4},$解得m=1,由①③数据可得$:(0.040/0.120)^{n}=2.2×10^{-4}/6.6×10^{-4},$解得n=1,由①中数据可得反应速率常数$k=2.2×10^{-4}/(0.025×0.040) L·mol^{-1}·s^{-1}=0.22 L·mol^{-1}·s^{-1},$则650 K时,初始一氧化碳浓度为$0.100 mol·L^{-1}、$二氧化氮浓度为$0.160 mol·L^{-1}$时,一氧化氮的反应速率为$0.22 L·mol^{-1}·s^{-1}×0.100 mol·L^{-1}×0.160 mol·L^{-1}=3.52×10^{-3} mol·L^{-1}·s^{-1}。$
(4)设平衡时反应ⅰ生成一氧化氮的浓度为a mol、反应ⅱ生成氮气物质的量为b mol,由题意可建立如下三段式$: CO(g)+NO_{2}(g)⇌CO_{2}(g)+NO(g) $起始/mol 2 2 0 0 转化/mol a a a a 平衡$/mol 2-a 2-a a a 4CO(g)+2NO_{2}(g)⇌4CO_{2}(g)+N_{2}(g) $起始/mol 2-a 2-a a 0 转化/mol 4b 2b 4b b 平衡/mol 2-a-4b 2-a-2b a+4b b 由二氧化氮和二氧化碳的物质的量可得:①2-a-2b=0.3,②a+4b=1.8,解得a=1.6、b=0.05,则反应ⅰ的平衡常数为(1.8/2×1.6/2)/(0.2/2×0.3/2)=48。
(5)由化学式可知,五羰基合锰的价电子数为17、五羰基合铬的价电子数为16、四羰基合钴的价电子数为17、四羰基合镍的价电子数为18,则由题意可知,四羰基合镍能够稳定存在。
(6)由晶胞结构可知,晶胞中碳原子与碳原子的最大距离为体对角线,则距离为√3b nm;晶胞中位于顶点、面心、体内的碳原子个数为8×1/8+6×1/2+4=8,设晶体的密度为$d g/cm^{3},$由晶胞的质量公式可得$:8×12/N_{A}=(10^{-7}b)^{3}d,$解得$d=8×12/(10^{-21}b^{3}N_{A})。$ 答案$ (1)-283 (2)1067 (3)1 1 3.52×10^{-3} (4)48 (5)D (6)√3b 8×12/(10^{-21}b^{3}N_{A})$
16. (14 分)$[Co(NH_{3})_{5}Cl]Cl_{2}$ 是一种易溶于热水,微溶于冷水,难溶于乙醇的紫红色晶体,可利用右图装置制备。
已知:①$Co^{2+}$ 在溶液中较稳定,$[Co(NH_{3})_{6}]^{2+}$ 具有较强还原性; $[Co(NH_{3})_{5}H_{2}O]Cl_{3}$ 为深红色晶体;

②$K_{sp}(AgCl)=1.56× 10^{-10}$,$K_{sp}(AgSCN)=1.0× 10^{-12}$。
具体实验步骤如下:
Ⅰ. 在锥形瓶中,将 $12.5\ g\ NH_{4}Cl$ 溶于 $50\ mL$ 水中,加热至沸,加入 $25.0\ g$ 研细的 $CoCl_{2}· 6H_{2}O$ 晶体,溶解得到混合溶液;
Ⅱ. 将上述混合液倒入仪器 A 中,用冰水浴冷却,利用仪器 B 分批次加入 $75\ mL$ 试剂 X,并充分搅拌,无沉淀析出;
Ⅲ. 再利用仪器 C 逐滴加入 $20\ mL$ 试剂 Y,水浴加热至 $50\sim 60^{\circ}C$,不断搅拌溶液,直到气泡终止放出,溶液变为深红色;
Ⅳ. 再换另一个仪器 C 慢慢注入 $75\ mL$ 浓盐酸,$50\sim 60^{\circ}C$ 水浴加热 $20\ min$,再用冰水浴冷却至室温,便有大量紫红色晶体析出,最后转移至布氏漏斗中减压过滤;
Ⅴ. 依次用不同试剂洗涤晶体,再将晶体转移至烘箱中干燥 1 小时,最终得到 $m\ g$ 产品。
请回答下列问题:
(1)研细 $CoCl_{2}· 6H_{2}O$ 晶体的仪器名称为
(2)步骤Ⅱ、步骤Ⅲ中使用试剂 X 和试剂 Y 分别为
①浓氨水 ②$NaOH$ 溶液 ③$KMnO_{4}$ 溶液 ④$30\%$ 双氧水
(3)写出步骤Ⅲ中发生反应的离子方程式:
(4)步骤Ⅴ中使用的洗涤试剂有冰水、乙醇、冷的盐酸,洗涤剂使用的先后顺序是冰水、
(5)最终获得产品会含少量杂质 $[Co(NH_{3})_{4}Cl_{2}]Cl$ 或 $[Co(NH_{3})_{6}]Cl_{3}$,产品组成可表示为 $[Co(NH_{3})_{x}Cl_{y}]Cl_{z}$,通过测定 $z$ 值可进一步测定产品纯度,进行如下实验:
实验Ⅰ:称取一定质量的产品溶解后,加入几滴 $K_{2}CrO_{4}$ 溶液作指示剂,用 $c\ mol· L^{-1}\ AgNO_{3}$ 标准溶液滴定达终点时,消耗 $V_{1}\ mL$。
实验Ⅱ:另取相同质量的产品,加入 $V_{2}\ mL$ 稍过量 $c\ mol· L^{-1}\ AgNO_{3}$ 标准溶液,加热至沸使钴配合物分解,加入硝基苯静置、分层,将白色沉淀完全包裹,再加入几滴 $Fe(NO_{3})_{3}$ 溶液作指示剂,用 $c\ mol· L^{-1}\ KSCN$ 标准溶液滴定剩余的 $AgNO_{3}$,达终点时消耗 $V_{3}\ mL$。
计算 $x=$
已知:①$Co^{2+}$ 在溶液中较稳定,$[Co(NH_{3})_{6}]^{2+}$ 具有较强还原性; $[Co(NH_{3})_{5}H_{2}O]Cl_{3}$ 为深红色晶体;

②$K_{sp}(AgCl)=1.56× 10^{-10}$,$K_{sp}(AgSCN)=1.0× 10^{-12}$。
具体实验步骤如下:
Ⅰ. 在锥形瓶中,将 $12.5\ g\ NH_{4}Cl$ 溶于 $50\ mL$ 水中,加热至沸,加入 $25.0\ g$ 研细的 $CoCl_{2}· 6H_{2}O$ 晶体,溶解得到混合溶液;
Ⅱ. 将上述混合液倒入仪器 A 中,用冰水浴冷却,利用仪器 B 分批次加入 $75\ mL$ 试剂 X,并充分搅拌,无沉淀析出;
Ⅲ. 再利用仪器 C 逐滴加入 $20\ mL$ 试剂 Y,水浴加热至 $50\sim 60^{\circ}C$,不断搅拌溶液,直到气泡终止放出,溶液变为深红色;
Ⅳ. 再换另一个仪器 C 慢慢注入 $75\ mL$ 浓盐酸,$50\sim 60^{\circ}C$ 水浴加热 $20\ min$,再用冰水浴冷却至室温,便有大量紫红色晶体析出,最后转移至布氏漏斗中减压过滤;
Ⅴ. 依次用不同试剂洗涤晶体,再将晶体转移至烘箱中干燥 1 小时,最终得到 $m\ g$ 产品。
请回答下列问题:
(1)研细 $CoCl_{2}· 6H_{2}O$ 晶体的仪器名称为
研钵
,仪器 D 中的试剂为$CaCl_{2}$或$P_{2}O_{5}$
。(2)步骤Ⅱ、步骤Ⅲ中使用试剂 X 和试剂 Y 分别为
①
、④
(填序号),步骤Ⅱ中 $75\ mL$ 试剂 X 需分批次滴加的目的是控制化学反应进行的速率,避免其反应过快;提高浓氨水的利用率
。①浓氨水 ②$NaOH$ 溶液 ③$KMnO_{4}$ 溶液 ④$30\%$ 双氧水
(3)写出步骤Ⅲ中发生反应的离子方程式:
$2[Co(NH_{3})_{6}]^{2+} + H_{2}O_{2} + 2NH^{+}_{4}\xlongequal{}2[Co(NH_{3})_{5}H_{2}O]^{3+} + 4NH_{3}$
。(4)步骤Ⅴ中使用的洗涤试剂有冰水、乙醇、冷的盐酸,洗涤剂使用的先后顺序是冰水、
冷的盐酸、乙醇
。(5)最终获得产品会含少量杂质 $[Co(NH_{3})_{4}Cl_{2}]Cl$ 或 $[Co(NH_{3})_{6}]Cl_{3}$,产品组成可表示为 $[Co(NH_{3})_{x}Cl_{y}]Cl_{z}$,通过测定 $z$ 值可进一步测定产品纯度,进行如下实验:
实验Ⅰ:称取一定质量的产品溶解后,加入几滴 $K_{2}CrO_{4}$ 溶液作指示剂,用 $c\ mol· L^{-1}\ AgNO_{3}$ 标准溶液滴定达终点时,消耗 $V_{1}\ mL$。
实验Ⅱ:另取相同质量的产品,加入 $V_{2}\ mL$ 稍过量 $c\ mol· L^{-1}\ AgNO_{3}$ 标准溶液,加热至沸使钴配合物分解,加入硝基苯静置、分层,将白色沉淀完全包裹,再加入几滴 $Fe(NO_{3})_{3}$ 溶液作指示剂,用 $c\ mol· L^{-1}\ KSCN$ 标准溶液滴定剩余的 $AgNO_{3}$,达终点时消耗 $V_{3}\ mL$。
计算 $x=$
$3+\frac{3V_{1}}{V_{2}-V_{3}}$
(用 $V_{1}、V_{2}$ 和 $V_{3}$ 表示);若实验Ⅱ中加入硝基苯的量太少,会导致 $y$ 值偏小
(填“偏大”“偏小”或“不变”)。
答案:
16. 解析
(1)研细${CoCl_{2}· 6H_{2}O}$晶体的仪器名称为研钵;D装置的作用是用于吸收生成的${NH_{3}}$防止其污染环境,因此D中试剂为${CaCl_{2}}$或${P_{2}O_{5}}$。
(2)步骤Ⅱ、步骤Ⅲ中使用试剂X为浓氨水,试剂Y为30%双氧水;步骤Ⅱ中75 mL试剂X需分批次滴加的目的是控制化学反应进行的速率,避免其反应过快;提高浓氨水的利用率。
(3)步骤Ⅲ用${H_{2}O_{2}}$氧化${[Co(NH_{3})_{6}]^{2+}}$,可得${[Co(NH_{3})_{5}H_{2}O]^{3+}}$,反应方程式为${2[Co(NH_{3})_{6}]^{2+} + H_{2}O_{2} + 2NH^{+}_{4}\xlongequal{}2[Co(NH_{3})_{5}H_{2}O]^{3+} + 4NH_{3}}$。
(4)由于${[Co(NH_{3})_{5}Cl]Cl_{2}}$是一种易溶于热水,微溶于冷水,难溶于乙醇的晶体,因此洗涤时,先用冷水洗去表面杂质,再用冷的盐酸洗涤,使反应${[Co(NH_{3})_{5}H_{2}O]^{3+} + Cl^{-}⇌ [Co(NH_{3})_{5}Cl]^{2+} + H_{2}O}$平衡正向移动,减少产物损失,再用乙醇洗去冷的盐酸。
(5)配合物${[Co(NH_{3})_{x}Cl_{y}]Cl_{z}}$中钴的配位数为6,即$x + y = 6$,且化合价代数和为0,即$y + z = 3$,由实验Ⅰ可知,溶液中${Cl^{-}}$的物质的量为$10^{-3}cV_{1}\ mol$,实验Ⅱ中${KSCN}$标准溶液滴定剩余的${AgNO_{3}}$的离子方程式为${Ag^{+} + SCN^{-}\xlongequal{}AgSCN\downarrow}$,即剩余的${AgNO_{3}}$的物质的量为$10^{-3}cV_{3}\ mol$,由题意得,产品中氯元素存在形式均为${Cl^{-}}$,与${Cl^{-}}$反应的${AgNO_{3}}$的物质的量为$10^{-3}c(V_{2}-V_{3})\ mol$,$y:z=[10^{-3}c(V_{2}-V_{3})-10^{-3}cV_{1}]:10^{-3}cV_{1}=(V_{2}-V_{3}-V_{1}):V_{1}$,可得方程组$\begin{cases}x + y = 6\\y + z = 3\frac{y}{z}=\frac{V_{2}-V_{3}-V_{1}}{V_{1}}\end{cases}$,解得$x = 3+\frac{3V_{1}}{V_{2}-V_{3}}$,$y = 3-\frac{3V_{1}}{V_{2}-V_{3}}$,$z=\frac{3V_{1}}{V_{2}-V_{3}}$;由于${AgCl}$和${AgSCN}$的组成和结构相似,且$K_{sp}({AgCl})>K_{sp}({AgSCN})$,若实验Ⅱ中加入硝基苯的量太少,${AgCl}$沉淀会与${SCN^{-}}$接触,出现沉淀的转化,使得$V_{3}$偏大,$y$值偏小。 答案
(1)研钵 ${CaCl_{2}}$或${P_{2}O_{5}}$
(2)① ④ 控制化学反应进行的速率,避免其反应过快;提高浓氨水的利用率
(3)${2[Co(NH_{3})_{6}]^{2+} + H_{2}O_{2} + 2NH^{+}_{4}\xlongequal{}}{2[Co(NH_{3})_{5}H_{2}O]^{3+} + 4NH_{3}}$
(4)冷的盐酸、乙醇
(5)$3+\frac{3V_{1}}{V_{2}-V_{3}}$ 偏小
(1)研细${CoCl_{2}· 6H_{2}O}$晶体的仪器名称为研钵;D装置的作用是用于吸收生成的${NH_{3}}$防止其污染环境,因此D中试剂为${CaCl_{2}}$或${P_{2}O_{5}}$。
(2)步骤Ⅱ、步骤Ⅲ中使用试剂X为浓氨水,试剂Y为30%双氧水;步骤Ⅱ中75 mL试剂X需分批次滴加的目的是控制化学反应进行的速率,避免其反应过快;提高浓氨水的利用率。
(3)步骤Ⅲ用${H_{2}O_{2}}$氧化${[Co(NH_{3})_{6}]^{2+}}$,可得${[Co(NH_{3})_{5}H_{2}O]^{3+}}$,反应方程式为${2[Co(NH_{3})_{6}]^{2+} + H_{2}O_{2} + 2NH^{+}_{4}\xlongequal{}2[Co(NH_{3})_{5}H_{2}O]^{3+} + 4NH_{3}}$。
(4)由于${[Co(NH_{3})_{5}Cl]Cl_{2}}$是一种易溶于热水,微溶于冷水,难溶于乙醇的晶体,因此洗涤时,先用冷水洗去表面杂质,再用冷的盐酸洗涤,使反应${[Co(NH_{3})_{5}H_{2}O]^{3+} + Cl^{-}⇌ [Co(NH_{3})_{5}Cl]^{2+} + H_{2}O}$平衡正向移动,减少产物损失,再用乙醇洗去冷的盐酸。
(5)配合物${[Co(NH_{3})_{x}Cl_{y}]Cl_{z}}$中钴的配位数为6,即$x + y = 6$,且化合价代数和为0,即$y + z = 3$,由实验Ⅰ可知,溶液中${Cl^{-}}$的物质的量为$10^{-3}cV_{1}\ mol$,实验Ⅱ中${KSCN}$标准溶液滴定剩余的${AgNO_{3}}$的离子方程式为${Ag^{+} + SCN^{-}\xlongequal{}AgSCN\downarrow}$,即剩余的${AgNO_{3}}$的物质的量为$10^{-3}cV_{3}\ mol$,由题意得,产品中氯元素存在形式均为${Cl^{-}}$,与${Cl^{-}}$反应的${AgNO_{3}}$的物质的量为$10^{-3}c(V_{2}-V_{3})\ mol$,$y:z=[10^{-3}c(V_{2}-V_{3})-10^{-3}cV_{1}]:10^{-3}cV_{1}=(V_{2}-V_{3}-V_{1}):V_{1}$,可得方程组$\begin{cases}x + y = 6\\y + z = 3\frac{y}{z}=\frac{V_{2}-V_{3}-V_{1}}{V_{1}}\end{cases}$,解得$x = 3+\frac{3V_{1}}{V_{2}-V_{3}}$,$y = 3-\frac{3V_{1}}{V_{2}-V_{3}}$,$z=\frac{3V_{1}}{V_{2}-V_{3}}$;由于${AgCl}$和${AgSCN}$的组成和结构相似,且$K_{sp}({AgCl})>K_{sp}({AgSCN})$,若实验Ⅱ中加入硝基苯的量太少,${AgCl}$沉淀会与${SCN^{-}}$接触,出现沉淀的转化,使得$V_{3}$偏大,$y$值偏小。 答案
(1)研钵 ${CaCl_{2}}$或${P_{2}O_{5}}$
(2)① ④ 控制化学反应进行的速率,避免其反应过快;提高浓氨水的利用率
(3)${2[Co(NH_{3})_{6}]^{2+} + H_{2}O_{2} + 2NH^{+}_{4}\xlongequal{}}{2[Co(NH_{3})_{5}H_{2}O]^{3+} + 4NH_{3}}$
(4)冷的盐酸、乙醇
(5)$3+\frac{3V_{1}}{V_{2}-V_{3}}$ 偏小
查看更多完整答案,请扫码查看


