2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
18. (14分)氟元素电负性大、原子半径小,用氟化试剂将氟引入化合物有望改变物质的生物学特性。常用的氟化试剂包含金属氟化物、氟化铵、${XeF_{2}}$、${XeF_{4}}$、${XeF_{6}}$等。回答下列问题:
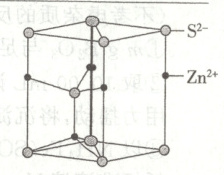
(1)${NH^{+}_{4}}$与${K^{+}}$半径接近,两者的盐类晶体结构大多相似。如${KCl}$、${NH_{4}Cl}$、${KBr}$、${NH_{4}Br}$、${KF}$均为${NaCl}$型晶体,但是${NH_{4}F}$为六方${ZnS}$型晶体,六方${ZnS}$晶胞结构如图。${NH_{4}F}$与${KF}$配位数不同的原因为
(2)已知:ⅰ.${Xe(g) + F_{2}(g)⇌ XeF_{2}(g)}$ $\Delta H_{1}=-107\ {kJ· mol^{-1}}$;
ⅱ.${XeF_{2}(g) + F_{2}(g)⇌ XeF_{4}(g)}$ $\Delta H_{2}=-99\ {kJ· mol^{-1}}$;
ⅲ.${XeF_{4}(g) + F_{2}(g)⇌ XeF_{6}(g)}$ $\Delta H_{3}=-73\ {kJ· mol^{-1}}$。
①${XeF_{2}}$、${XeF_{4}}$均可以作为氟化试剂将苯氟化,反应如下:
${XeF_{2}(g) + C_{6}H_{6}(g)⇌ Xe(g) + C_{6}H_{5}F(g) + HF(g)}$
$\Delta H_{4}=a\ {kJ· mol^{-1}}$
${XeF_{4}(g) + 2C_{6}H_{6}(g)⇌ Xe(g) + 2C_{6}H_{5}F(g) + 2HF(g)}$ $\Delta H_{5}$
则$\Delta H_{5}=$
②一定温度下,$1\ {mol}\ {Xe}$与一定量${F_{2}}$通入恒压反应容器发生反应ⅰ、ⅱ、ⅲ,平衡时,${XeF_{2}:XeF_{4}}$、${XeF_{6}}$的物质的量随${F_{2}}$的平衡分压$p{(F_{2})}$的变化如图。当$p{(F_{2}) > 20\ {kPa}}$时,可以近似认为平衡时$n{(Xe)=0}$。
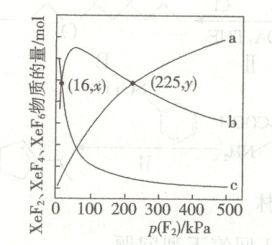
${XeF_{6}}$物质的量所对应的曲线为
(3)${XeO_{3}}$易溶于水,水溶液酸性条件稳定,碱性条件分解释放${Xe}$与${O_{2}}$,其机理如下:
Ⅰ.${XeO_{3} + OH^{-}⇌ HXeO^{-}_{4}}$(快) $K=3000\ {L· mol^{-1}}(25\ {^{\circ}C})$;
Ⅱ.${2HXeO^{-}_{4}\xlongequal{}2Xe + 3O_{2} + 2OH^{-}}$(慢)。
反应Ⅱ的速率方程为$v=kc{(HXeO^{-}_{4})}$,$k$为反应速率常数。$25\ {^{\circ}C}$时,向$1\ {L}\ 1\ {mol· L^{-1}}$的${XeO_{3}}$水溶液中加固体${NaOH}$,开始放出气体时,测定溶液的${pH}$为$10$,产生${Xe}$的速率先变快后变慢,原因是
(1)${NH^{+}_{4}}$与${K^{+}}$半径接近,两者的盐类晶体结构大多相似。如${KCl}$、${NH_{4}Cl}$、${KBr}$、${NH_{4}Br}$、${KF}$均为${NaCl}$型晶体,但是${NH_{4}F}$为六方${ZnS}$型晶体,六方${ZnS}$晶胞结构如图。${NH_{4}F}$与${KF}$配位数不同的原因为
$NH_{4}F$中$NH^{+}_{4}$中的氢与$F^{-}$可以形成氢键,氢键具有饱和性和方向性
。
(2)已知:ⅰ.${Xe(g) + F_{2}(g)⇌ XeF_{2}(g)}$ $\Delta H_{1}=-107\ {kJ· mol^{-1}}$;
ⅱ.${XeF_{2}(g) + F_{2}(g)⇌ XeF_{4}(g)}$ $\Delta H_{2}=-99\ {kJ· mol^{-1}}$;
ⅲ.${XeF_{4}(g) + F_{2}(g)⇌ XeF_{6}(g)}$ $\Delta H_{3}=-73\ {kJ· mol^{-1}}$。
①${XeF_{2}}$、${XeF_{4}}$均可以作为氟化试剂将苯氟化,反应如下:
${XeF_{2}(g) + C_{6}H_{6}(g)⇌ Xe(g) + C_{6}H_{5}F(g) + HF(g)}$
$\Delta H_{4}=a\ {kJ· mol^{-1}}$
${XeF_{4}(g) + 2C_{6}H_{6}(g)⇌ Xe(g) + 2C_{6}H_{5}F(g) + 2HF(g)}$ $\Delta H_{5}$
则$\Delta H_{5}=$
$2a - 8$
${kJ· mol^{-1}}$(用含$a$的式子表示)。②一定温度下,$1\ {mol}\ {Xe}$与一定量${F_{2}}$通入恒压反应容器发生反应ⅰ、ⅱ、ⅲ,平衡时,${XeF_{2}:XeF_{4}}$、${XeF_{6}}$的物质的量随${F_{2}}$的平衡分压$p{(F_{2})}$的变化如图。当$p{(F_{2}) > 20\ {kPa}}$时,可以近似认为平衡时$n{(Xe)=0}$。

${XeF_{6}}$物质的量所对应的曲线为
a
(填“${a}$”“${b}$”或“${c}$”)。$x$小于
(填“大于”“小于”或“等于”)$y$。为获得最多的${XeF_{4}}$,$p{(F_{2})}=$60
${kPa}$,若此时体系总压为$100\ {kPa}$,则初始投料比$n{(F_{2})}:n{(Xe)}=$$7:2$
。(3)${XeO_{3}}$易溶于水,水溶液酸性条件稳定,碱性条件分解释放${Xe}$与${O_{2}}$,其机理如下:
Ⅰ.${XeO_{3} + OH^{-}⇌ HXeO^{-}_{4}}$(快) $K=3000\ {L· mol^{-1}}(25\ {^{\circ}C})$;
Ⅱ.${2HXeO^{-}_{4}\xlongequal{}2Xe + 3O_{2} + 2OH^{-}}$(慢)。
反应Ⅱ的速率方程为$v=kc{(HXeO^{-}_{4})}$,$k$为反应速率常数。$25\ {^{\circ}C}$时,向$1\ {L}\ 1\ {mol· L^{-1}}$的${XeO_{3}}$水溶液中加固体${NaOH}$,开始放出气体时,测定溶液的${pH}$为$10$,产生${Xe}$的速率先变快后变慢,原因是
反应Ⅱ产生$OH^{-}$,会促进反应Ⅰ平衡向右移动,$HXeO^{-}_{4}$浓度增大,从而提高反应速率;反应一段时间后,$HXeO^{-}_{4}$浓度降低,反应速率降低
。反应结束后,溶液中${OH^{-}}$的浓度为0.23
${mol· L^{-1}}$(忽略溶液温度和体积变化)。
答案:
18.解析
(1)KF为离子晶体,其中不存在其他作用力,但是$NH_{4}F$中$NH^{+}_{4}$中的氢与$F^{-}$可以形成氢键,并且氢键具有饱和性和方向性,从而影响了其配位数的个数。
(2)①设反应:①${Xe(g) + F_{2}(g) \rightleftharpoons XeF_{2}(g)}$,②${XeF_{2}(g) + F_{2}(g) \rightleftharpoons XeF_{4}(g)}$,③${XeF_{4}(g) + F_{2}(g) \rightleftharpoons XeF_{6}(g)}$,④${XeF_{2}(g) + C_{6}H_{6}(g) \rightleftharpoons Xe(g) + C_{6}H_{5}F(g) + HF(g)}$,⑤${XeF_{4}(g) + 2C_{6}H_{6}(g) \rightleftharpoons Xe(g) + 2C_{6}H_{5}F(g) + 2HF(g)}$,根据盖斯定律⑤ = 2×④ + ① - ②,则$\Delta H_{5} = 2 × \Delta H_{4} + \Delta H_{1} - \Delta H_{2} = (2a - 8)\ kJ · mol^{- 1}$。
②一定温度下,1 mol Xe与一定量$F_{2}$通入恒压反应容器发生反应Ⅰ、Ⅱ、Ⅲ,初始生成$XeF_{2}$,随着氟气的通入使得$XeF_{2}$逐渐转化为含氟更多的氟化物,故a、b、c分别$XeF_{6}$、$XeF_{4}$、$XeF_{2}$,故$XeF_{6}$物质的量所对应的曲线为a。x和y分别是题图中两个交点的纵坐标,分别是$XeF_{2}$、$XeF_{4}$的物质的量及$XeF_{4}$、$XeF_{6}$的物质的量,由于二者相等,根据元素守恒有$n(Xe) + n(XeF_{2}) + n(XeF_{4}) + n(XeF_{6}) = 1\ mol$,$n(XeF_{2}) = n(XeF_{4}) = \frac{1\ mol - n(Xe) - n(XeF_{6})}{2}$,$n(XeF_{4}) = n(XeF_{6}) = \frac{1\ mol - n(XeF_{2})}{2}$(此点n(Xe)近似为零),通过图像向下作垂线分别找到与$XeF_{6}$和$XeF_{2}$的交点,不难看出左边的交点高于右边,左边再加上Xe,应该更高一点,因此x < y。
为获得最多的$XeF_{4}$,对应的应该是$XeF_{4}$曲线的最高点,此时恰好对应着$XeF_{2}$、$XeF_{6}$的交点,从图像利用交点可以看出方程式Ⅱ的$K_{p} = \frac{1}{16}$,方程式Ⅲ的$K_{p} = \frac{1}{225}$,则方程式${XeF_{2} + 2F_{2} \rightleftharpoons XeF_{6}}$的$K_{p} = \frac{1}{p^{2}(F_{2})} = \frac{1}{16} × \frac{1}{225} = \frac{1}{3600}$,则$p(F_{2}) = \sqrt{3600} = 60$即$p(F_{2}) = 60\ kPa$,此时$XeF_{4}$含量最大。
若此时体系总压为100 kPa,若求初始投料比$n(F_{2}):n(Xe)$,$XeF_{4}$达最大值时$F_{2}$的分压$p(F_{2}) = 60\ kPa$,此时体系总压为100 kPa,则$XeF_{2}$、$XeF_{4}$、$XeF_{6}$的总压为40 kPa,此时$XeF_{2}$和$XeF_{6}$是1:1,则二者的平均式为$XeF_{4}$,可看作只含$XeF_{4}$,则此时可看作$n(F_{2}):n(XeF_{4}) = 6:4$,依据元素守恒,则起始投料比$n(F_{2}):n(Xe) = (6 + 8):4 = 7:2$。
(3)$25^{\circ}C$时,向1 L $1\ mol · L^{- 1}$的$XeO_{3}$水溶液中加固体NaOH,开始放出气体时,测定溶液的pH为10。产生Xe的速率先变快后变慢,原因是反应Ⅱ产生$OH^{-}$,会促进反应Ⅰ平衡向右移动,$HXeO^{-}_{4}$浓度增大,从而提高反应速率,反应一段时间后,$HXeO^{-}_{4}$浓度降低,反应速率降低。
开始放出气体时,测定溶液的pH为10,依据反应Ⅰ的平衡常数$K = \frac{c(HXeO^{-}_{4})}{c(XeO_{3}) · c(OH^{-})} = 3000$,$\frac{c(HXeO^{-}_{4})}{c(XeO_{3})} = 3000 × 1 × 10^{- 4} = \frac{3}{10}$,开始时为1 L $1\ mol · L^{- 1}$的$XeO_{3}$水溶液,根据Xe元素守恒,则$c(HXeO^{-}_{4}) = \frac{3}{13}\ mol · L^{- 1}$,此时电荷守恒式$c(Na^{+}) + c(H^{+}) = c(OH^{-}) + c(HXeO^{-}_{4})$,由于溶液pH为10,$c(OH^{-}) \gg c(H^{+})$,$c(H^{+})$可忽略,$c(Na^{+}) = c(OH^{-}) + c(HXeO^{-}_{4}) = 1 × 10^{- 4}\ mol · L^{- 1} + \frac{3}{13}\ mol · L^{- 1} \approx \frac{3}{13}\ mol · L^{- 1}$,反应结束时,
溶液体积不变,$c(Na^{+})$不变,$c(HXeO^{-}_{4})$接近0,$c(Na^{+}) \approx c(OH^{-}) = \frac{3}{13}\ mol · L^{- 1} \approx 0.23\ mol · L^{- 1}$。
答案
(1)$NH_{4}F$中$NH^{+}_{4}$中的氢与$F^{-}$可以形成氢键,氢键具有饱和性和方向性
(2)①$2a - 8$ ②a 小于 60 $7:2$
(3)反应Ⅱ产生$OH^{-}$,会促进反应Ⅰ平衡向右移动,$HXeO^{-}_{4}$浓度增大,从而提高反应速率;反应一段时间后,$HXeO^{-}_{4}$浓度降低,反应速率降低 0.23
高考仿真模拟卷
(1)KF为离子晶体,其中不存在其他作用力,但是$NH_{4}F$中$NH^{+}_{4}$中的氢与$F^{-}$可以形成氢键,并且氢键具有饱和性和方向性,从而影响了其配位数的个数。
(2)①设反应:①${Xe(g) + F_{2}(g) \rightleftharpoons XeF_{2}(g)}$,②${XeF_{2}(g) + F_{2}(g) \rightleftharpoons XeF_{4}(g)}$,③${XeF_{4}(g) + F_{2}(g) \rightleftharpoons XeF_{6}(g)}$,④${XeF_{2}(g) + C_{6}H_{6}(g) \rightleftharpoons Xe(g) + C_{6}H_{5}F(g) + HF(g)}$,⑤${XeF_{4}(g) + 2C_{6}H_{6}(g) \rightleftharpoons Xe(g) + 2C_{6}H_{5}F(g) + 2HF(g)}$,根据盖斯定律⑤ = 2×④ + ① - ②,则$\Delta H_{5} = 2 × \Delta H_{4} + \Delta H_{1} - \Delta H_{2} = (2a - 8)\ kJ · mol^{- 1}$。
②一定温度下,1 mol Xe与一定量$F_{2}$通入恒压反应容器发生反应Ⅰ、Ⅱ、Ⅲ,初始生成$XeF_{2}$,随着氟气的通入使得$XeF_{2}$逐渐转化为含氟更多的氟化物,故a、b、c分别$XeF_{6}$、$XeF_{4}$、$XeF_{2}$,故$XeF_{6}$物质的量所对应的曲线为a。x和y分别是题图中两个交点的纵坐标,分别是$XeF_{2}$、$XeF_{4}$的物质的量及$XeF_{4}$、$XeF_{6}$的物质的量,由于二者相等,根据元素守恒有$n(Xe) + n(XeF_{2}) + n(XeF_{4}) + n(XeF_{6}) = 1\ mol$,$n(XeF_{2}) = n(XeF_{4}) = \frac{1\ mol - n(Xe) - n(XeF_{6})}{2}$,$n(XeF_{4}) = n(XeF_{6}) = \frac{1\ mol - n(XeF_{2})}{2}$(此点n(Xe)近似为零),通过图像向下作垂线分别找到与$XeF_{6}$和$XeF_{2}$的交点,不难看出左边的交点高于右边,左边再加上Xe,应该更高一点,因此x < y。
为获得最多的$XeF_{4}$,对应的应该是$XeF_{4}$曲线的最高点,此时恰好对应着$XeF_{2}$、$XeF_{6}$的交点,从图像利用交点可以看出方程式Ⅱ的$K_{p} = \frac{1}{16}$,方程式Ⅲ的$K_{p} = \frac{1}{225}$,则方程式${XeF_{2} + 2F_{2} \rightleftharpoons XeF_{6}}$的$K_{p} = \frac{1}{p^{2}(F_{2})} = \frac{1}{16} × \frac{1}{225} = \frac{1}{3600}$,则$p(F_{2}) = \sqrt{3600} = 60$即$p(F_{2}) = 60\ kPa$,此时$XeF_{4}$含量最大。
若此时体系总压为100 kPa,若求初始投料比$n(F_{2}):n(Xe)$,$XeF_{4}$达最大值时$F_{2}$的分压$p(F_{2}) = 60\ kPa$,此时体系总压为100 kPa,则$XeF_{2}$、$XeF_{4}$、$XeF_{6}$的总压为40 kPa,此时$XeF_{2}$和$XeF_{6}$是1:1,则二者的平均式为$XeF_{4}$,可看作只含$XeF_{4}$,则此时可看作$n(F_{2}):n(XeF_{4}) = 6:4$,依据元素守恒,则起始投料比$n(F_{2}):n(Xe) = (6 + 8):4 = 7:2$。
(3)$25^{\circ}C$时,向1 L $1\ mol · L^{- 1}$的$XeO_{3}$水溶液中加固体NaOH,开始放出气体时,测定溶液的pH为10。产生Xe的速率先变快后变慢,原因是反应Ⅱ产生$OH^{-}$,会促进反应Ⅰ平衡向右移动,$HXeO^{-}_{4}$浓度增大,从而提高反应速率,反应一段时间后,$HXeO^{-}_{4}$浓度降低,反应速率降低。
开始放出气体时,测定溶液的pH为10,依据反应Ⅰ的平衡常数$K = \frac{c(HXeO^{-}_{4})}{c(XeO_{3}) · c(OH^{-})} = 3000$,$\frac{c(HXeO^{-}_{4})}{c(XeO_{3})} = 3000 × 1 × 10^{- 4} = \frac{3}{10}$,开始时为1 L $1\ mol · L^{- 1}$的$XeO_{3}$水溶液,根据Xe元素守恒,则$c(HXeO^{-}_{4}) = \frac{3}{13}\ mol · L^{- 1}$,此时电荷守恒式$c(Na^{+}) + c(H^{+}) = c(OH^{-}) + c(HXeO^{-}_{4})$,由于溶液pH为10,$c(OH^{-}) \gg c(H^{+})$,$c(H^{+})$可忽略,$c(Na^{+}) = c(OH^{-}) + c(HXeO^{-}_{4}) = 1 × 10^{- 4}\ mol · L^{- 1} + \frac{3}{13}\ mol · L^{- 1} \approx \frac{3}{13}\ mol · L^{- 1}$,反应结束时,
溶液体积不变,$c(Na^{+})$不变,$c(HXeO^{-}_{4})$接近0,$c(Na^{+}) \approx c(OH^{-}) = \frac{3}{13}\ mol · L^{- 1} \approx 0.23\ mol · L^{- 1}$。
答案
(1)$NH_{4}F$中$NH^{+}_{4}$中的氢与$F^{-}$可以形成氢键,氢键具有饱和性和方向性
(2)①$2a - 8$ ②a 小于 60 $7:2$
(3)反应Ⅱ产生$OH^{-}$,会促进反应Ⅰ平衡向右移动,$HXeO^{-}_{4}$浓度增大,从而提高反应速率;反应一段时间后,$HXeO^{-}_{4}$浓度降低,反应速率降低 0.23
高考仿真模拟卷
查看更多完整答案,请扫码查看


