2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
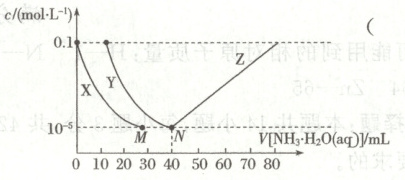
13. 向 $10 ~mL$ 浓度均为 $0.1 ~mol · L^{-1}$ 的 $FeSO_{4}$ 和 $ZnSO_{4}$ 的混合溶液中加人 $0.1 ~mol · L^{-1}$ 氨水, 溶液中金属元素有不同的存在形式, 它们的物质的量浓度与氨水 $(K_{b}=1.8 × 10^{-5})$ 体积关系如下图所示。测得 $M 、 N$ 点溶液 $pH$ 分别为 $8.04 、 8.95$ 。
已知: i. $Zn^{2+}+4 NH_{3} \rightleftharpoons[Zn(NH_{3})_{4}]^{2+}$ $K_{稳 }=\frac{c([Zn(NH_{3})_{4}]^{2+})}{c^{4}(NH_{3}) · c(Zn^{2+})}=10^{9.06}$ ;
ii. $K_{sp}[Zn(OH)_{2}]<K_{sp}[Fe(OH)_{2}]$ 。
下列说法正确的是(
A.曲线 $Y$ 表示 $Zn^{2+}$
B.$K_{sp}[Fe(OH)_{2}]=10^{-16.92}$
C.$N$ 点以后, 锌元素主要以 $Zn^{2+}$ 形式存在
D.$Zn(OH)_{2}+4 NH_{3} \rightleftharpoons[Zn(NH_{3})_{4}]^{2+}+2 OH^{-}$ $K=10^{-7.86}$
已知: i. $Zn^{2+}+4 NH_{3} \rightleftharpoons[Zn(NH_{3})_{4}]^{2+}$ $K_{稳 }=\frac{c([Zn(NH_{3})_{4}]^{2+})}{c^{4}(NH_{3}) · c(Zn^{2+})}=10^{9.06}$ ;
ii. $K_{sp}[Zn(OH)_{2}]<K_{sp}[Fe(OH)_{2}]$ 。

下列说法正确的是(
D
)A.曲线 $Y$ 表示 $Zn^{2+}$
B.$K_{sp}[Fe(OH)_{2}]=10^{-16.92}$
C.$N$ 点以后, 锌元素主要以 $Zn^{2+}$ 形式存在
D.$Zn(OH)_{2}+4 NH_{3} \rightleftharpoons[Zn(NH_{3})_{4}]^{2+}+2 OH^{-}$ $K=10^{-7.86}$
答案:
13.D [由于Ksp[Zn(OH)2]<Ksp[Fe(OH)2],向10mL浓度均为0.1mol·L−1的FeSO4和ZnSO4的混合溶液中加入0.1mol·L−1氨水,Zn2+先沉淀,分析图像,曲线X表示Zn2+,曲线Y表示Fe2+,曲线Z表示[Zn(NH3)4]2+。曲线Y表示Fe2+,A错误;N点c(Fe2+)=10−5mol·L−1,pH=8.95,c(H+)=10−8.95mol·L−1,c(OH−)=Kw/c(H+)=1×10−14/10−8.95mol·L−1=10−5.05mol·L−1,Ksp[Fe(OH)2]=c(Fe2+)·c2(OH−)=1×10−5×(10−5.05)2=10−15.1,B错误;N点锌元素的主要存在形式为Zn(OH)2,N点以后,锌元素主要以[Zn(NH3)4]2+形式存在,C错误;由M点数据可知,Ksp[Zn(OH)2]=1×10−5×(1×10−14/10−8.04)2=10−16.92,反应Zn(OH)2+4NH3⇌[Zn(NH3)4]2++2OH−的K=c([Zn(NH3)4]2+)·c2(OH−)/c4(NH3)=c([Zn(NH3)4]2+)·c2(OH−)·c(Zn2+)/c4(NH3)·c(Zn2+)=K稳·Ksp[Zn(OH)2]=109.06×10−16.92=10−7.86,D正确。]
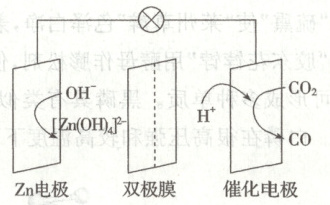
14. 水系 $Zn-CO_{2}$ 电池在碳循环方面具有广阔的应用前景。该电池的示意图如下, 其中双极膜在工作时催化 $H_{2} O$ 解离为 $H^{+}$ 和 $OH^{-}$, 并在直流电场的作用下分别向两极迁移。下列说法正确的是(
A.放电时, $Zn$ 电极为负极, 发生还原反应
B.充电时, $OH^{-}$ 从 $Zn$ 电极通过双极膜到达催化电极发生反应
C.放电时, 催化电极上的反应为 $CO_{2}+2 H^{+}+2 e^{-}=CO+H_{2} O$
D.充电时, $Zn$ 电极上的反应为 $Zn^{2+}+2 e^{-}=Zn$
C
)
A.放电时, $Zn$ 电极为负极, 发生还原反应
B.充电时, $OH^{-}$ 从 $Zn$ 电极通过双极膜到达催化电极发生反应
C.放电时, 催化电极上的反应为 $CO_{2}+2 H^{+}+2 e^{-}=CO+H_{2} O$
D.充电时, $Zn$ 电极上的反应为 $Zn^{2+}+2 e^{-}=Zn$
答案:
14.C [由图知,该电池在放电时,Zn作负极失去电子,发生氧化反应,电极反应式为Zn−2e−+4OH−=[Zn(OH)4]2−,催化电极作为正极得到电子,发生还原反应,电极反应式为CO2+2H++2e−=CO+H2O,充电时,Zn作为阴极,双极膜在工作时催化H2O解离为H+和OH−,氢离子移向阴极,电极反应式为[Zn(OH)4]2−+4H++2e−=Zn+4H2O,催化电极为阳极,双极膜在工作时催化H2O解离为H+和OH−,氢氧根移向阳极,电极反应式为CO+2OH−−2e−=CO2+H2O。由分析知,放电时,Zn电极为负极,发生氧化反应,A错误;由分析知,充电时,OH−从双极膜向催化电极移动,并发生反应,OH−不能通过双极膜,B错误;由分析知,放电时,催化电极上的反应为CO2+2H++2e−=CO+H2O,C正确;充电时,Zn电极上的反应为[Zn(OH)4]2−+4H++2e−=Zn+4H2O,D错误。]
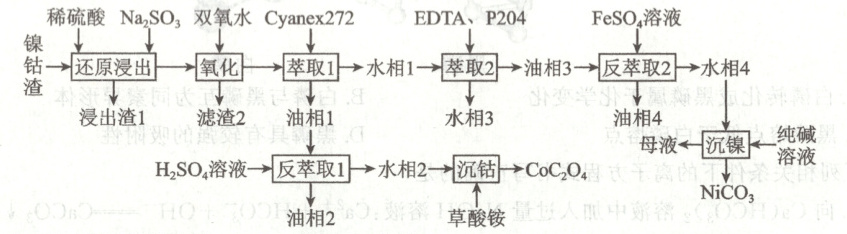
15. (16 分) 从镍钴渣 (主要成分为 $CoO 、 Co_{2} O_{3} 、 NiO$, 少量 $Fe_{2} O_{3} 、 SiO_{2}$ ) 中提取碳酸镍并制备草酸钴晶体 $(CoC_{2} O_{4} · 2 H_{2} O)$ 的工艺流程如下, 回答下列问题:
已知: $Co_{2} O_{3}$ 不溶于稀硫酸, $CoO$ 可溶于稀硫酸。
(1) 钴属于_______区元素, 基态钴原子的价层电子排布式为_______。
(2) “还原浸出”步骤中发生的氧化还原反应的离子方程式分别是 $Fe_{2} O_{3}+SO_{3}^{2-}+4 H^{+}=2 Fe^{2+}+SO_{4}^{2-}+2 H_{2} O$ 和_______。
(3) 若“滤渣 2 ”的主要成分为 $FeOOH$, 则“氧化”操作中生成 $FeOOH$ 的离子方程式为_______。
(4) 萃取操作中, 下列有关说法错误的是_______(填字母)。
A. 萃取振荡时, 分液漏斗下口应倾斜向下
B. 分液时, 应先将下层液体由分液漏斗下口放出
C. 分液时, 上层液体也应由分液漏斗下口放出
(5) 制备的 $NiCO_{3}$ 可制取 $Ni_{2} O_{3}$ 。 $NiCO_{3}$ 和 $Ni(OH)_{2}$ 煅烧均可得到 $Ni_{2} O_{3}$, 前者得到的 $Ni_{2} O_{3}$ 比表面积更大, 其原因是_______。
(6) 草酸钴 $(CoC_{2} O_{4})$ 是制备钴的氧化物的重要原料。在空气中煅烧 $CoC_{2} O_{4}$ 生成含钴的氧化物和 $CO_{2}$, 测得充分煅烧后固体的质量为 $2.49 ~g, CO_{2}$ 体积为 $1.344 ~L$ (标准状况下), 则该含钴氧化物的化学式为_______, 写出该步反应的化学方程式:_______。

已知: $Co_{2} O_{3}$ 不溶于稀硫酸, $CoO$ 可溶于稀硫酸。
(1) 钴属于_______区元素, 基态钴原子的价层电子排布式为_______。
(2) “还原浸出”步骤中发生的氧化还原反应的离子方程式分别是 $Fe_{2} O_{3}+SO_{3}^{2-}+4 H^{+}=2 Fe^{2+}+SO_{4}^{2-}+2 H_{2} O$ 和_______。
(3) 若“滤渣 2 ”的主要成分为 $FeOOH$, 则“氧化”操作中生成 $FeOOH$ 的离子方程式为_______。
(4) 萃取操作中, 下列有关说法错误的是_______(填字母)。
A. 萃取振荡时, 分液漏斗下口应倾斜向下
B. 分液时, 应先将下层液体由分液漏斗下口放出
C. 分液时, 上层液体也应由分液漏斗下口放出
(5) 制备的 $NiCO_{3}$ 可制取 $Ni_{2} O_{3}$ 。 $NiCO_{3}$ 和 $Ni(OH)_{2}$ 煅烧均可得到 $Ni_{2} O_{3}$, 前者得到的 $Ni_{2} O_{3}$ 比表面积更大, 其原因是_______。
(6) 草酸钴 $(CoC_{2} O_{4})$ 是制备钴的氧化物的重要原料。在空气中煅烧 $CoC_{2} O_{4}$ 生成含钴的氧化物和 $CO_{2}$, 测得充分煅烧后固体的质量为 $2.49 ~g, CO_{2}$ 体积为 $1.344 ~L$ (标准状况下), 则该含钴氧化物的化学式为_______, 写出该步反应的化学方程式:_______。
答案:
(1)d $3d^{7}4s^{2}$
(2)$Co_{2}O_{3}+SO_{3}^{2 - }+4H^{+}=2Co^{2 + }+SO_{4}^{2 - }+2H_{2}O$
(3)$2Fe^{2 + }+H_{2}O_{2}+2H_{2}O=2FeOOH\downarrow +4H^{+}$
(4)AC
(5)$NiCO_{3}$煅烧生成$Ni_{2}O_{3}$的同时生成$CO_{2}$气体,$CO_{2}$气体受热逸出,导致生成的$Ni_{2}O_{3}$疏松多孔,比表面积更大
(6)$Co_{2}O_{3}$ $4CoC_{2}O_{4}+3O_{2}\stackrel{煅烧}{=\!=\!=}2Co_{2}O_{3}+8CO_{2}$
(1)d $3d^{7}4s^{2}$
(2)$Co_{2}O_{3}+SO_{3}^{2 - }+4H^{+}=2Co^{2 + }+SO_{4}^{2 - }+2H_{2}O$
(3)$2Fe^{2 + }+H_{2}O_{2}+2H_{2}O=2FeOOH\downarrow +4H^{+}$
(4)AC
(5)$NiCO_{3}$煅烧生成$Ni_{2}O_{3}$的同时生成$CO_{2}$气体,$CO_{2}$气体受热逸出,导致生成的$Ni_{2}O_{3}$疏松多孔,比表面积更大
(6)$Co_{2}O_{3}$ $4CoC_{2}O_{4}+3O_{2}\stackrel{煅烧}{=\!=\!=}2Co_{2}O_{3}+8CO_{2}$
查看更多完整答案,请扫码查看


