2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
17. (14分)尿素是一种重要化工生产原料。工业上以液氨和二氧化碳为原料,在高温、高压条件下直接合成尿素,主要反应如下:
① ${2NH_{3}(l) + CO_{2}(g){<=>[][]}H_{2}NCOONH_{4}(l)}$ $\Delta H = -103.7\ {kJ· mol^{-1}}$
② ${H_{2}NCOONH_{4}(l){<=>[][]}CO(NH_{2})_{2}(l) + H_{2}O(l)}$ $\Delta H = +15.5\ {kJ· mol^{-1}}$
请回答下列问题:
(1) ${2NH_{3}(l) + CO_{2}(g){<=>[][]}CO(NH_{2})_{2}(l) + H_{2}O(l)}$ $\Delta H =$
(2) 工业上直接合成尿素时,选择较高温度的原因是
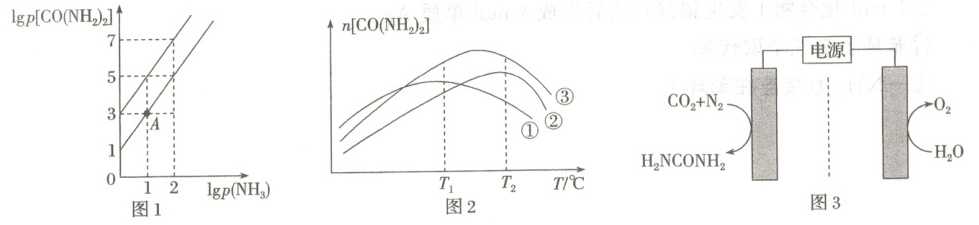
(3) 在$T_{1}\ {^{\circ}C}$和$T_{2}\ {^{\circ}C}$时($T_{1} < T_{2}$),向恒容容器中投入等物质的量的两种反应物,发生反应:${HN\xlongequal{}C\xlongequal{}O(g) + NH_{3}(g){<=>[][]}CO(NH_{2})_{2}(g)}$ $\Delta H < 0$。
① 平衡时$\lg p({NH_{3}})$与$\lg p[{CO(NH_{2})_{2}}]$的关系如图1所示,$p$为物质的分压(单位为${kPa}$)。若$v_{正} = k_{正}× p({HNCO})× p({NH_{3}})$,$v_{逆} = k_{逆}× p[{CO(NH_{2})_{2}}]$。
$T_{1}\ {^{\circ}C}$时,$\dfrac{k_{正}}{k_{逆}} =$
② 图2为在不同催化剂下,反应至相同时间,容器中尿素的物质的量随温度变化的曲线,则在$T_{2}\ {^{\circ}C}$,催化效率最好的是催化剂
(4) 电化学合成尿素为实现碳、氮中和与减轻环境污染提供了一种很有前景的解决方案。某碱性电化学合成系统如图3所示,该系统中,阴极反应为
① ${2NH_{3}(l) + CO_{2}(g){<=>[][]}H_{2}NCOONH_{4}(l)}$ $\Delta H = -103.7\ {kJ· mol^{-1}}$
② ${H_{2}NCOONH_{4}(l){<=>[][]}CO(NH_{2})_{2}(l) + H_{2}O(l)}$ $\Delta H = +15.5\ {kJ· mol^{-1}}$
请回答下列问题:
(1) ${2NH_{3}(l) + CO_{2}(g){<=>[][]}CO(NH_{2})_{2}(l) + H_{2}O(l)}$ $\Delta H =$
-88.2
${kJ· mol^{-1}}$。(2) 工业上直接合成尿素时,选择较高温度的原因是
升高温度,反应速率加快,单位时间内尿素的产率增大
。(3) 在$T_{1}\ {^{\circ}C}$和$T_{2}\ {^{\circ}C}$时($T_{1} < T_{2}$),向恒容容器中投入等物质的量的两种反应物,发生反应:${HN\xlongequal{}C\xlongequal{}O(g) + NH_{3}(g){<=>[][]}CO(NH_{2})_{2}(g)}$ $\Delta H < 0$。
① 平衡时$\lg p({NH_{3}})$与$\lg p[{CO(NH_{2})_{2}}]$的关系如图1所示,$p$为物质的分压(单位为${kPa}$)。若$v_{正} = k_{正}× p({HNCO})× p({NH_{3}})$,$v_{逆} = k_{逆}× p[{CO(NH_{2})_{2}}]$。
$T_{1}\ {^{\circ}C}$时,$\dfrac{k_{正}}{k_{逆}} =$
1000
${kPa^{-1}}$。$T_{2}\ {^{\circ}C}$时此反应的标准平衡常数$K^{\theta} =$1000
。{已知:分压$=$总压$×$该组分物质的量分数,对于反应:$d{D(g)} + e{E(g)}{<=>[][]}g{G(g)}$,$K^{\theta} = \dfrac{\left[\dfrac{p({G})}{p^{\theta}}\right]^{g}}{\left[\dfrac{p({D})}{p^{\theta}}\right]^{d}\left[\dfrac{p({E})}{p^{\theta}}\right]^{e}}$,其中$p^{\theta} = 100\ {kPa}$,$p({G})$、$p({D})$、$p({E})$为各组分的平衡分压}② 图2为在不同催化剂下,反应至相同时间,容器中尿素的物质的量随温度变化的曲线,则在$T_{2}\ {^{\circ}C}$,催化效率最好的是催化剂
③
(填序号)。温度大于$T_{2}\ {^{\circ}C}$时,$n[{CO(NH_{2})_{2}}]$下降的原因可能是随温度升高,催化剂活性降低,反应速率降低,相同时间内生成的CO(NH₂)₂的物质的量减少(或该反应放热,温度升高,平衡逆向移动,产物减少;或可能发生了副反应)(任写一点)
(答出一点即可,不考虑物质的稳定性)。(4) 电化学合成尿素为实现碳、氮中和与减轻环境污染提供了一种很有前景的解决方案。某碱性电化学合成系统如图3所示,该系统中,阴极反应为
CO₂ + N₂ + 6e⁻ + 5H₂O = CO(NH₂)₂ + 6OH⁻
。
答案:
17.解析
(1)根据盖斯定律,反应①$+$反应②可得${2NH_{3}(l) + CO_{2}(g)⇌ CO(NH_{2})_{2}(l) + H_{2}O(l)}$ $\Delta H = (-103.7 + 15.5)\ \mathrm{kJ· mol^{-1}} = -88.2\ \mathrm{kJ· mol^{-1}}$。
(2)工业上直接合成尿素时,选择较高温度的原因是:升高温度,反应速率加快,单位时间内尿素的产率增大。
(3)①因为$T_{1}\lt T_{2}$,故在图1中上方线是$T_{1}$对应的曲线,平衡时$v_{正} = v_{逆}$,即$k_{正}\ p({HNCO})× p({NH_{3}}) = k_{逆}× p[{CO(NH_{2})_{2}}]$,代入$\lg p({NH_{3}}) = 1$、$\lg p[{CO(NH_{2})_{2}}] = 5$,$\dfrac{k_{正}}{k_{逆}} = \dfrac{p[{CO(NH_{2})_{2}}]}{p({HNCO})× p({NH_{3}})} = \dfrac{10^{5}}{10× 10}\ \mathrm{kPa^{-1}} = 1\ 000\ \mathrm{kPa^{-1}}$;根据标准平衡常数的表达式,代入${A}$点的数据,可得$K^{\Theta} = \dfrac{\dfrac{p[{CO(NH_{2})_{2}}]}{p^{\Theta}}}{\dfrac{p({HNCO})}{p^{\Theta}}× \dfrac{p({NH_{3}})}{p^{\Theta}}} = \dfrac{\dfrac{1\ 000}{100}}{\dfrac{10}{100}× \dfrac{10}{100}} = 1\ 000$。
②由图2可知在$T_{1}\ ^{\circ}C$时,催化剂③的作用下${CO(NH_{2})_{2}}$的物质的量较多时,其物质的量分数较大,故催化效率最好的是催化剂③。催化剂存在活化温度,在活化温度时催化效率较高,由图2的${CO(NH_{2})_{2}}$的物质的量随着温度的变化趋势可知,温度大于$T_{2}\ ^{\circ}C$时,$n[{CO(NH_{2})_{2}}]$下降的原因可能有:随温度升高,催化剂活性降低,反应速率降低,相同时间内生成的${CO(NH_{2})_{2}}$的物质的量减少;该反应放热,温度升高,平衡逆向移动,产物减少;可能发生了副反应。
(4)根据化合价的变化可看出,合成尿素一极为阴极,该电极反应为${CO_{2} + N_{2} + 6e^{-} + 5H_{2}O\xlongequal{}CO(NH_{2})_{2} + 6OH^{-}}$。
答案
(1)$-88.2$
(2)升高温度,反应速率加快,单位时间内尿素的产率增大
(3)①$1\ 000$ $1\ 000$ ②③ 随温度升高,催化剂活性降低,反应速率降低,相同时间内生成的${CO(NH_{2})_{2}}$的物质的量减少(或该反应放热,温度升高,平衡逆向移动,产物减少;或可能发生了副反应)(任写一点)
(4)${CO_{2} + N_{2} + 6e^{-} + 5H_{2}O\xlongequal{}CO(NH_{2})_{2} + 6OH^{-}}$
(1)根据盖斯定律,反应①$+$反应②可得${2NH_{3}(l) + CO_{2}(g)⇌ CO(NH_{2})_{2}(l) + H_{2}O(l)}$ $\Delta H = (-103.7 + 15.5)\ \mathrm{kJ· mol^{-1}} = -88.2\ \mathrm{kJ· mol^{-1}}$。
(2)工业上直接合成尿素时,选择较高温度的原因是:升高温度,反应速率加快,单位时间内尿素的产率增大。
(3)①因为$T_{1}\lt T_{2}$,故在图1中上方线是$T_{1}$对应的曲线,平衡时$v_{正} = v_{逆}$,即$k_{正}\ p({HNCO})× p({NH_{3}}) = k_{逆}× p[{CO(NH_{2})_{2}}]$,代入$\lg p({NH_{3}}) = 1$、$\lg p[{CO(NH_{2})_{2}}] = 5$,$\dfrac{k_{正}}{k_{逆}} = \dfrac{p[{CO(NH_{2})_{2}}]}{p({HNCO})× p({NH_{3}})} = \dfrac{10^{5}}{10× 10}\ \mathrm{kPa^{-1}} = 1\ 000\ \mathrm{kPa^{-1}}$;根据标准平衡常数的表达式,代入${A}$点的数据,可得$K^{\Theta} = \dfrac{\dfrac{p[{CO(NH_{2})_{2}}]}{p^{\Theta}}}{\dfrac{p({HNCO})}{p^{\Theta}}× \dfrac{p({NH_{3}})}{p^{\Theta}}} = \dfrac{\dfrac{1\ 000}{100}}{\dfrac{10}{100}× \dfrac{10}{100}} = 1\ 000$。
②由图2可知在$T_{1}\ ^{\circ}C$时,催化剂③的作用下${CO(NH_{2})_{2}}$的物质的量较多时,其物质的量分数较大,故催化效率最好的是催化剂③。催化剂存在活化温度,在活化温度时催化效率较高,由图2的${CO(NH_{2})_{2}}$的物质的量随着温度的变化趋势可知,温度大于$T_{2}\ ^{\circ}C$时,$n[{CO(NH_{2})_{2}}]$下降的原因可能有:随温度升高,催化剂活性降低,反应速率降低,相同时间内生成的${CO(NH_{2})_{2}}$的物质的量减少;该反应放热,温度升高,平衡逆向移动,产物减少;可能发生了副反应。
(4)根据化合价的变化可看出,合成尿素一极为阴极,该电极反应为${CO_{2} + N_{2} + 6e^{-} + 5H_{2}O\xlongequal{}CO(NH_{2})_{2} + 6OH^{-}}$。
答案
(1)$-88.2$
(2)升高温度,反应速率加快,单位时间内尿素的产率增大
(3)①$1\ 000$ $1\ 000$ ②③ 随温度升高,催化剂活性降低,反应速率降低,相同时间内生成的${CO(NH_{2})_{2}}$的物质的量减少(或该反应放热,温度升高,平衡逆向移动,产物减少;或可能发生了副反应)(任写一点)
(4)${CO_{2} + N_{2} + 6e^{-} + 5H_{2}O\xlongequal{}CO(NH_{2})_{2} + 6OH^{-}}$
查看更多完整答案,请扫码查看


