2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
11. 下列各实验的操作现象或结论有错误的是(

C
)
答案:
11.C [将${SO_{2}}$分别通入品红的乙醇溶液和品红的水溶液,观察到品红的乙醇溶液不褪色,而品红的水溶液慢慢褪色,可以说明使品红褪色的不是${SO_{2}}$,而是${SO_{2}}$与水反应后的产物,A不符合题意;将氧气通入${H_{2}S}$的水溶液中,溶液变浑浊说明发生反应:${O_{2} + 2H_{2}S\xlongequal{}2S\downarrow + 2H_{2}O}$,则氧化性:${O_{2}}>{S}$,氧的非金属性大于硫,B不符合题意;气体${X}$可以是不具有强氧化性的氨气,向溶有${SO_{2}}$的${BaCl_{2}}$溶液中通入氨气,氨气与二氧化硫优先反应生成亚硫酸铵,然后亚硫酸铵与${BaCl_{2}}$发生复分解反应生成${BaSO_{3}}$白色沉淀,C符合题意;白色沉淀可能是${BaSO_{4}}$,也可能是${AgCl}$,溶液中不一定含有${SO^{2-}_{4}}$,也可能含有${Ag^{+}}$,D不符合题意。]
12. 某科研所以${CO_{2}}$与丙胺为原料实现了乙酸盐和丙腈的高选择性合成,该装置的工作原理如图所示。下列说法正确的是(
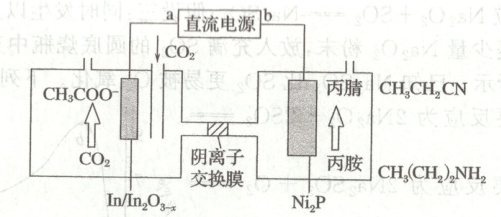
A.$a$极为直流电源的负极,电子经电池内部流向$b$极
B.电解一段时间后,阴极区溶液${pH}$降低
C.每生成$1\ {mol}$丙腈,同时生成$2\ {mol}\ {CH_{3}COO^{-}}$
D.在${Ni_{2}P}$电极上发生的反应为${CH_{3}(CH_{2})_{2}NH_{2} - 4e^{-}\xlongequal{}CH_{3}CH_{2}CN + 4H^{+}}$
D
)
A.$a$极为直流电源的负极,电子经电池内部流向$b$极
B.电解一段时间后,阴极区溶液${pH}$降低
C.每生成$1\ {mol}$丙腈,同时生成$2\ {mol}\ {CH_{3}COO^{-}}$
D.在${Ni_{2}P}$电极上发生的反应为${CH_{3}(CH_{2})_{2}NH_{2} - 4e^{-}\xlongequal{}CH_{3}CH_{2}CN + 4H^{+}}$
答案:
12.D [$a$极连接的电极上${CO_{2}}$转化为${CH_{3}COO^{-}}$,${C}$元素化合价降低,发生还原反应,故为阴极,因此$a$极为电源负极;电子只能通过外电路流动,电池内部为离子定向移动,A错误;阴极区发生${CO_{2}}$的还原反应,生成${CH_{3}COO^{-}}$,反应可能消耗${H^{+}}$(如${2CO_{2} + 8e^{-} + 7H^{+}\xlongequal{}CH_{3}COO^{-} + 2H_{2}O}$),${H^{+}}$浓度降低,溶液${pH}$升高,B错误;阳极丙胺生成丙腈的反应为${CH_{3}(CH_{2})_{2}NH_{2} - 4e^{-}\xlongequal{}CH_{3}CH_{2}CN + 4H^{+}}$,生成$1\ \mathrm{mol}$丙腈转移$4\ \mathrm{mol}$电子;阴极${CO_{2}}$生成${CH_{3}COO^{-}}$时,${2CO_{2} + 8e^{-} + 7H^{+}\xlongequal{}CH_{3}COO^{-} + 2H_{2}O}$,共得到$8{e^{-}}$,即生成$1\ \mathrm{mol}\ {CH_{3}COO^{-}}$转移$8\ \mathrm{mol}$电子。根据电子守恒,转移$4\ \mathrm{mol}$电子时生成$0.5\ \mathrm{mol}\ {CH_{3}COO^{-}}$,故生成$1\ \mathrm{mol}$丙腈时生成$0.5\ \mathrm{mol}\ {CH_{3}COO^{-}}$,C错误;${Ni_{2}P}$电极上丙胺${[CH_{3}(CH_{2})_{2}NH_{2}]}$转化为丙腈${(CH_{3}CH_{2}CN)}$,失去$4$个${H^{+}}$(即失去$4{e^{-}}$),反应式为${CH_{3}(CH_{2})_{2}NH_{2} - 4e^{-}\xlongequal{}CH_{3}CH_{2}CN + 4H^{+}}$,D正确。]
13. 黑色${HgS}$的水溶性很差。已知:${HgS + 2H^{+}{<=>[][]}Hg^{2+} + H_{2}S}$平衡常数$K = 10^{-30.8}$,$K_{sp}({HgS}) = 10^{-51.8}$,$K_{sp}({FeS}) = 10^{-17.2}$。下列有关说法错误的是(
A.降低${pH}$可以增大${HgS}$的溶解量
B.可将${H_{2}S}$气体通入${Hg^{2+}}$水溶液中制备${HgS}$
C.${H_{2}S}$的电离平衡常数的乘积$K_{a1}· K_{a2} = 10^{-20}$
D.用${FeS}$除废水中${Hg^{2+}}$:${FeS(s) + Hg^{2+}(aq)\xlongequal{}HgS(s) + Fe^{2+}(aq)}$,平衡常数$K = 10^{34.6}$
C
)A.降低${pH}$可以增大${HgS}$的溶解量
B.可将${H_{2}S}$气体通入${Hg^{2+}}$水溶液中制备${HgS}$
C.${H_{2}S}$的电离平衡常数的乘积$K_{a1}· K_{a2} = 10^{-20}$
D.用${FeS}$除废水中${Hg^{2+}}$:${FeS(s) + Hg^{2+}(aq)\xlongequal{}HgS(s) + Fe^{2+}(aq)}$,平衡常数$K = 10^{34.6}$
答案:
13.C [已知:${HgS + 2H^{+}⇌ Hg^{2+} + H_{2}S}$,降低${pH}$,氢离子浓度增大,平衡正向移动,${HgS}$的溶解量增大,A正确;${HgS}$的溶解平衡为${HgS(s)⇌ Hg^{2+}(aq) + S^{2-}(aq)}$,将${H_{2}S}$气体通入${Hg^{2+}}$水溶液中,${S^{2-}}$浓度增大,平衡逆向移动,可制备${HgS}$,B正确;${H_{2}S}$的电离平衡常数的乘积$K_{a1}· K_{a2}=\dfrac{c^{2}({H^{+}})· c({S^{2-}})· c({Hg^{2+}})}{c({H_{2}S})· c({Hg^{2+}})}=\dfrac{K_{sp}({HgS})}{K}=\dfrac{10^{-51.8}}{10^{-30.8}}=10^{-21}$,C错误;用${FeS}$除废水中${Hg^{2+}}$:${FeS(s) + Hg^{2+}(aq)\xlongequal{}HgS(s) + Fe^{2+}(aq)}$,平衡常数$K=\dfrac{c({Fe^{2+}})}{c({Hg^{2+}})}=\dfrac{\dfrac{c({Fe^{2+}})· c({S^{2-}})}{c({Hg^{2+}})· c({S^{2-}})}}{}=\dfrac{K_{sp}({FeS})}{K_{sp}({HgS})}=\dfrac{10^{-17.2}}{10^{-51.8}}=10^{34.6}$,D正确。]
14. ${N_{2}H_{4}}$是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某${Ru}$(Ⅱ)催化剂${[L-Ru-NH_{3}]^{+}}$能高效电催化氧化${NH_{3}}$合成${N_{2}H_{4}}$,其电极反应机理如图所示。下列说法错误的是(
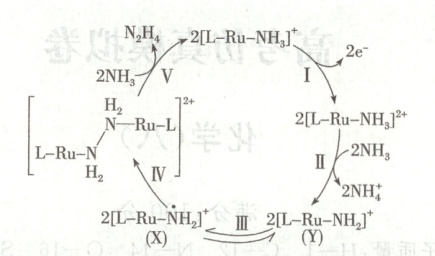
A.${NH^{+}_{4}}$与${N_{2}H_{4}}$中的${N}$原子杂化方式相同
B.${X}$和${Y}$中${Ru}$的化合价均为$+3$
C.反应Ⅱ没有发生氧化还原反应
D.图示过程发生在电解池阳极区
B
)
A.${NH^{+}_{4}}$与${N_{2}H_{4}}$中的${N}$原子杂化方式相同
B.${X}$和${Y}$中${Ru}$的化合价均为$+3$
C.反应Ⅱ没有发生氧化还原反应
D.图示过程发生在电解池阳极区
答案:
14.B [${NH^{+}_{4}}$中氮原子的价层电子对数为$4$,为$\mathrm{sp}^{3}$杂化,${N_{2}H_{4}}$中${N}$原子的价层电子对数为$3 + 1 = 4$,杂化类型为$\mathrm{sp}^{3}$,A正确;${X}$与${Y}$可相互转化,当${Y}$转化为${X}$时,${N}$原子的孤电子对拆为$2$个电子,并转移给${Ru}$原子$1$个电子,${Ru}$为$+2$价,即${X}$中也为$+2$价,B错误;反应Ⅱ中发生了质子转移、无元素化合价发生变化,没有发生氧化还原反应,C正确;图示过程失去了电子为氧化反应,发生在电解池的阳极区,故D正确。]
查看更多完整答案,请扫码查看


