2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15. (14 分)四氧化三铁俗称磁性氧化铁,常用于制造录音磁带和电讯器材,也可作颜料和抛光剂。某工厂以硫铁矿烧渣(主要含有${Fe}$、${Al}$、${Ca}$的氧化物及${SiO2}$)为原料,制备${Fe3O4}$的工艺流程如图所示。
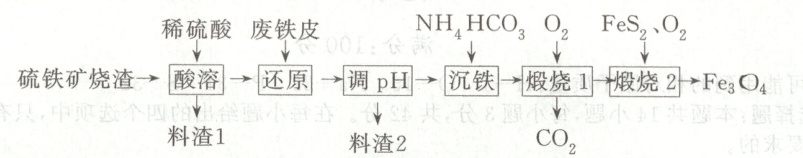
已知:$K_{sp}[{Fe(OH)3}]=8× 10^{-38}$、$K_{sp}[{Fe(OH)2}]=4.9× 10^{-17}$、$K_{sp}[{Al(OH)3}]=1.0× 10^{-33}$。
回答下列问题:
(1)“酸溶”硫铁矿烧渣时,为了加快酸溶速率除了加热外,还可采取的措施有_______、_______(任写两条)。
(2)料渣$1$的主要成分有_______;废铁皮在使用前要用热碱液进行洗涤,其目的是_______。
(3)已知溶液中$c({Fe^{2+}})=0.49\ mol·L^{-1}$,要使${Al^{3+}}$沉淀完全,则“调$pH$”的范围是_______(一般离子浓度$\leqslant 1× 10^{-5}\ mol·L^{-1}$认为沉淀完全)。
(4)加入${NH4HCO3}$“沉铁”时,发生反应的离子方程式为_______。
(5)“煅烧$1$”的目的是将${FeCO3}$转化为${Fe2O3}$。在实验室进行该实验时,下列仪器中不需要的有_______(填仪器名称)。
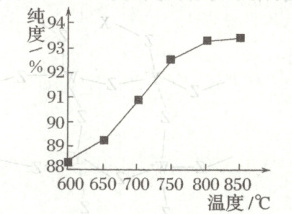
(6)“煅烧$2$”时温度对${Fe3O4}$的纯度有很大影响。已知温度对${Fe3O4}$纯度的影响如图所示,则“煅烧$2$”时,温度最好控制在_______${^{\circ}C}$;“煅烧$2$”阶段应控制$\frac{n({FeS2})}{n({Fe2O3})}$的最佳比例为_______。

已知:$K_{sp}[{Fe(OH)3}]=8× 10^{-38}$、$K_{sp}[{Fe(OH)2}]=4.9× 10^{-17}$、$K_{sp}[{Al(OH)3}]=1.0× 10^{-33}$。
回答下列问题:
(1)“酸溶”硫铁矿烧渣时,为了加快酸溶速率除了加热外,还可采取的措施有_______、_______(任写两条)。
(2)料渣$1$的主要成分有_______;废铁皮在使用前要用热碱液进行洗涤,其目的是_______。
(3)已知溶液中$c({Fe^{2+}})=0.49\ mol·L^{-1}$,要使${Al^{3+}}$沉淀完全,则“调$pH$”的范围是_______(一般离子浓度$\leqslant 1× 10^{-5}\ mol·L^{-1}$认为沉淀完全)。
(4)加入${NH4HCO3}$“沉铁”时,发生反应的离子方程式为_______。
(5)“煅烧$1$”的目的是将${FeCO3}$转化为${Fe2O3}$。在实验室进行该实验时,下列仪器中不需要的有_______(填仪器名称)。

(6)“煅烧$2$”时温度对${Fe3O4}$的纯度有很大影响。已知温度对${Fe3O4}$纯度的影响如图所示,则“煅烧$2$”时,温度最好控制在_______${^{\circ}C}$;“煅烧$2$”阶段应控制$\frac{n({FeS2})}{n({Fe2O3})}$的最佳比例为_______。

答案:
15. 解析
(1)为了加快硫铁矿烧渣的酸溶速率,可以将硫铁矿烧渣粉碎,增大接触面积;也可以适当增大硫酸浓度或者搅拌等。
(2)稀硫酸酸浸时,${SiO_{2}}$与稀${H_{2}SO_{4}}$不反应,${CaO}$与稀${H_{2}SO_{4}}$反应生成微溶的${CaSO_{4}}$,故料渣1的主要成分是${SiO_{2}}$和${CaSO_{4}}$;废铁皮在使用前用热碱液洗涤的目的是除去表面的油污。
(3)要使${Al^{3+}}$沉淀完全则$c{(Al^{3+})}\leqslant 1× 10^{-5}\ mol· L^{-1}$,则$c{(OH^{-})}=\sqrt[3]{\dfrac{K_{sp}{[Al(OH)_{3}]}}{c{(Al^{3+})}}}=\sqrt[3]{\dfrac{1.0× 10^{-33}}{1× 10^{-5}}}=\sqrt[3]{1× 10^{-28}}=10^{-\frac{28}{3}}\ mol· L^{-1}$,则${pOH}=-\lg 10^{-\frac{28}{3}}\approx 9.3$,${pH}=14 - {pOH}\approx 4.7$。${Fe^{2+}}$不沉淀,此时$c{(Fe^{2+})}=0.49\ mol· L^{-1}$,由$K_{sp}{[Fe(OH)_{2}]}=c{(Fe^{2+})}· c^{2}{(OH^{-})}=4.9× 10^{-17}$,则$c{(OH^{-})}=1.0× 10^{-8}\ mol· L^{-1}$,则${pOH}=-\lg c{(OH^{-})}=8.0$,${pH}=6.0$,故${pH}$的范围为$4.7\leqslant {pH}< 6.0$。
(4)在含有${FeSO_{4}}$的溶液中加入${NH_{4}HCO_{3}}$,发生复分解反应生成${FeCO_{3}}$的离子方程式为${2HCO^{-}_{3} + Fe^{2+}\xlongequal{}FeCO_{3}\downarrow + CO_{2}\uparrow + H_{2}O}$。
(5)在实验室中煅烧固体,要用到坩埚、坩埚钳、三脚架、泥三角、酒精灯和玻璃棒,用不到蒸发皿和表面皿。
(6)由图可知,在$800\ ^{\circ}C$时,所得${Fe_{3}O_{4}}$的纯度比较高,再升高温度纯度变化不大,考虑到经济性,应选择煅烧温度为$800\ ^{\circ}C$;"煅烧2"阶段煅烧${Fe_{2}O_{3}}$和${FeS_{2}}$混合物制取${Fe_{3}O_{4}}$的化学方程式为${2FeS_{2} + 2Fe_{2}O_{3} + 5O_{2}\xlongequal{煅烧}2Fe_{3}O_{4} + 4SO_{2}}$,故应控制$\dfrac{n{(FeS_{2})}}{n{(Fe_{2}O_{3})}}$的最佳比例为$1:1$。
答案
(1)将硫铁矿烧渣粉碎 适当增大硫酸浓度
(2)${SiO_{2}}$和${CaSO_{4}}$ 去除废铁皮表面的油污
(3)$4.7\leqslant {pH}< 6.0$
(4)${2HCO^{-}_{3} + Fe^{2+}\xlongequal{}FeCO_{3}\downarrow + CO_{2}\uparrow + H_{2}O}$
(5)蒸发皿、表面皿
(6)$800$ $1:1$
(1)为了加快硫铁矿烧渣的酸溶速率,可以将硫铁矿烧渣粉碎,增大接触面积;也可以适当增大硫酸浓度或者搅拌等。
(2)稀硫酸酸浸时,${SiO_{2}}$与稀${H_{2}SO_{4}}$不反应,${CaO}$与稀${H_{2}SO_{4}}$反应生成微溶的${CaSO_{4}}$,故料渣1的主要成分是${SiO_{2}}$和${CaSO_{4}}$;废铁皮在使用前用热碱液洗涤的目的是除去表面的油污。
(3)要使${Al^{3+}}$沉淀完全则$c{(Al^{3+})}\leqslant 1× 10^{-5}\ mol· L^{-1}$,则$c{(OH^{-})}=\sqrt[3]{\dfrac{K_{sp}{[Al(OH)_{3}]}}{c{(Al^{3+})}}}=\sqrt[3]{\dfrac{1.0× 10^{-33}}{1× 10^{-5}}}=\sqrt[3]{1× 10^{-28}}=10^{-\frac{28}{3}}\ mol· L^{-1}$,则${pOH}=-\lg 10^{-\frac{28}{3}}\approx 9.3$,${pH}=14 - {pOH}\approx 4.7$。${Fe^{2+}}$不沉淀,此时$c{(Fe^{2+})}=0.49\ mol· L^{-1}$,由$K_{sp}{[Fe(OH)_{2}]}=c{(Fe^{2+})}· c^{2}{(OH^{-})}=4.9× 10^{-17}$,则$c{(OH^{-})}=1.0× 10^{-8}\ mol· L^{-1}$,则${pOH}=-\lg c{(OH^{-})}=8.0$,${pH}=6.0$,故${pH}$的范围为$4.7\leqslant {pH}< 6.0$。
(4)在含有${FeSO_{4}}$的溶液中加入${NH_{4}HCO_{3}}$,发生复分解反应生成${FeCO_{3}}$的离子方程式为${2HCO^{-}_{3} + Fe^{2+}\xlongequal{}FeCO_{3}\downarrow + CO_{2}\uparrow + H_{2}O}$。
(5)在实验室中煅烧固体,要用到坩埚、坩埚钳、三脚架、泥三角、酒精灯和玻璃棒,用不到蒸发皿和表面皿。
(6)由图可知,在$800\ ^{\circ}C$时,所得${Fe_{3}O_{4}}$的纯度比较高,再升高温度纯度变化不大,考虑到经济性,应选择煅烧温度为$800\ ^{\circ}C$;"煅烧2"阶段煅烧${Fe_{2}O_{3}}$和${FeS_{2}}$混合物制取${Fe_{3}O_{4}}$的化学方程式为${2FeS_{2} + 2Fe_{2}O_{3} + 5O_{2}\xlongequal{煅烧}2Fe_{3}O_{4} + 4SO_{2}}$,故应控制$\dfrac{n{(FeS_{2})}}{n{(Fe_{2}O_{3})}}$的最佳比例为$1:1$。
答案
(1)将硫铁矿烧渣粉碎 适当增大硫酸浓度
(2)${SiO_{2}}$和${CaSO_{4}}$ 去除废铁皮表面的油污
(3)$4.7\leqslant {pH}< 6.0$
(4)${2HCO^{-}_{3} + Fe^{2+}\xlongequal{}FeCO_{3}\downarrow + CO_{2}\uparrow + H_{2}O}$
(5)蒸发皿、表面皿
(6)$800$ $1:1$
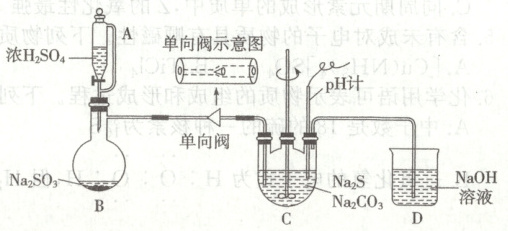
16. (16 分)实验室用${SO2}$通入${Na2S}$和${Na2CO3}$的混合溶液中来制备${Na2S2O3· 5H2O}$并测定所得产品纯度。
已知:①${Na2S2O3· 5H2O}$易溶于水,难溶于乙醇,温度高于$50\ {^{\circ}C}$易失去结晶水;
②${S2O^{2-}3}$酸性条件下易发生反应:${S2O^{2-}3 + 2H^+ \xlongequal{} S \downarrow + SO2 \uparrow + H2O}$。
实验步骤:
Ⅰ.${Na2S2O3}$的制备:装置$B$产生的${SO2}$缓慢地通入装置$C$中$n({Na2S}):n({Na2CO3})=2:1$的混合溶液,加热并搅拌至溶液$pH$约为$7$时,停止通入${SO2}$,停止搅拌和加热得混合溶液。
Ⅱ. 产品分离提纯:将$C$中混合溶液,经操作(a)、过滤、洗涤、干燥,得到${Na2S2O3· 5H2O}$粗产品。
Ⅲ. 产品纯度测定:取$m\ g$产品配制成$200\ mL$溶液,取出$20.00\ mL$置于锥形瓶中,加入淀粉溶液作指示剂,用$n\ mol·L^{-1}$的碘标准溶液滴定至终点,发生反应:${2Na2S2O3 + I2 \xlongequal{} 2NaI + Na2S4O6}$,滴定三次平均消耗碘溶液$x\ mL$,计算样品中${Na2S2O3· 5H2O}$纯度。
请回答下列问题:
(1)装置$C$的名称为_______。
(2)制取${Na2S2O3}$的反应的化学方程式为_______;$C$中反应结束时混合溶液$pH$过高或过低将导致${Na2S2O3}$产率降低,原因是_______。
(3)Ⅱ为产品的分离提纯。
①操作(a)为_______,为减少产品损失,粗产品可以用_______洗涤。
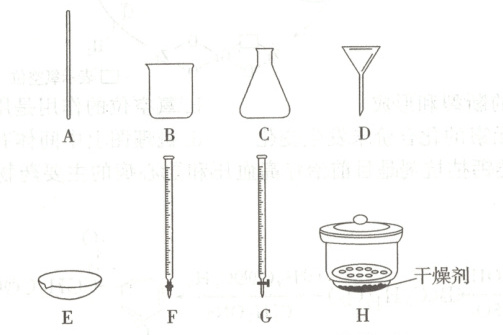
②从下图选出Ⅱ中可能使用到的仪器_______(填字母)。
(4)Ⅲ为氧化还原滴定法测定样品中${Na2S2O3· 5H2O}$的纯度。
①滴定终点的现象是_______。
②样品中${Na2S2O3· 5H2O}$的纯度为_______(用含$m$、$n$、$x$的代数式表示)。
已知:①${Na2S2O3· 5H2O}$易溶于水,难溶于乙醇,温度高于$50\ {^{\circ}C}$易失去结晶水;

②${S2O^{2-}3}$酸性条件下易发生反应:${S2O^{2-}3 + 2H^+ \xlongequal{} S \downarrow + SO2 \uparrow + H2O}$。
实验步骤:
Ⅰ.${Na2S2O3}$的制备:装置$B$产生的${SO2}$缓慢地通入装置$C$中$n({Na2S}):n({Na2CO3})=2:1$的混合溶液,加热并搅拌至溶液$pH$约为$7$时,停止通入${SO2}$,停止搅拌和加热得混合溶液。
Ⅱ. 产品分离提纯:将$C$中混合溶液,经操作(a)、过滤、洗涤、干燥,得到${Na2S2O3· 5H2O}$粗产品。
Ⅲ. 产品纯度测定:取$m\ g$产品配制成$200\ mL$溶液,取出$20.00\ mL$置于锥形瓶中,加入淀粉溶液作指示剂,用$n\ mol·L^{-1}$的碘标准溶液滴定至终点,发生反应:${2Na2S2O3 + I2 \xlongequal{} 2NaI + Na2S4O6}$,滴定三次平均消耗碘溶液$x\ mL$,计算样品中${Na2S2O3· 5H2O}$纯度。
请回答下列问题:
(1)装置$C$的名称为_______。
(2)制取${Na2S2O3}$的反应的化学方程式为_______;$C$中反应结束时混合溶液$pH$过高或过低将导致${Na2S2O3}$产率降低,原因是_______。
(3)Ⅱ为产品的分离提纯。
①操作(a)为_______,为减少产品损失,粗产品可以用_______洗涤。
②从下图选出Ⅱ中可能使用到的仪器_______(填字母)。

(4)Ⅲ为氧化还原滴定法测定样品中${Na2S2O3· 5H2O}$的纯度。
①滴定终点的现象是_______。
②样品中${Na2S2O3· 5H2O}$的纯度为_______(用含$m$、$n$、$x$的代数式表示)。
答案:
(1)三颈烧瓶(三口烧瓶)
(2)${4SO_{2} + Na_{2}CO_{3} + 2Na_{2}S\xlongequal{}3Na_{2}S_{2}O_{3} + CO_{2}}$ ${pH}$过高,${Na_{2}CO_{3}}$、${Na_{2}S}$反应不充分;${pH}$过低,导致${Na_{2}S_{2}O_{3}}$转化为S和${SO_{2}}$
(3)①蒸发浓缩、冷却结晶 乙醇 ②ABDEH
(4)①滴入最后一滴碘标准溶液后溶液由无色变蓝色,且半分钟内不恢复原色 ②$\dfrac{496nx}{m}\%$
(1)三颈烧瓶(三口烧瓶)
(2)${4SO_{2} + Na_{2}CO_{3} + 2Na_{2}S\xlongequal{}3Na_{2}S_{2}O_{3} + CO_{2}}$ ${pH}$过高,${Na_{2}CO_{3}}$、${Na_{2}S}$反应不充分;${pH}$过低,导致${Na_{2}S_{2}O_{3}}$转化为S和${SO_{2}}$
(3)①蒸发浓缩、冷却结晶 乙醇 ②ABDEH
(4)①滴入最后一滴碘标准溶液后溶液由无色变蓝色,且半分钟内不恢复原色 ②$\dfrac{496nx}{m}\%$
查看更多完整答案,请扫码查看


