2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
7. 用 $16.0\ mol· L^{-1}$ 浓硝酸配制 $3\ mol· L^{-1}$ 的硝酸。下列操作错误的是(
A.检查容量瓶是否漏水,至少倒置两次容量瓶
B.用量筒准确量取一定体积的浓硝酸转移到容量瓶中
C.转移溶液用玻璃棒引流时,将玻璃棒一端靠在容量瓶颈刻度线以下内壁上,不要让玻璃棒其他部位触及容量瓶口
D.试剂瓶在装入配制的硝酸溶液之前,应保持干燥
B
)A.检查容量瓶是否漏水,至少倒置两次容量瓶
B.用量筒准确量取一定体积的浓硝酸转移到容量瓶中
C.转移溶液用玻璃棒引流时,将玻璃棒一端靠在容量瓶颈刻度线以下内壁上,不要让玻璃棒其他部位触及容量瓶口
D.试剂瓶在装入配制的硝酸溶液之前,应保持干燥
答案:
7. B [检查容量瓶是否漏水,向容量瓶加入少量水,塞上瓶塞,倒置观察,不漏水的话,正立容量瓶,将瓶塞旋转180度,再倒置观察,如果也不漏水,则检漏完成,故至少倒置两次容量瓶,A正确;用量筒准确量取一定体积的浓硝酸,先在烧杯中稀释冷却后,再转移到容量瓶中,B错误;转移溶液用玻璃棒引流时,将玻璃棒一端靠在容量瓶颈刻度线以下内壁上,不要让玻璃棒其他部位触及容量瓶口,以防转移时液体流到容量瓶外,C正确;试剂瓶在装入配制的硝酸溶液之前,应保持干燥,否则会导致溶液浓度变小,D正确。]
8. 标准状态下,气态反应物和生成物的相对能量与反应历程如图所示,已知 $O_{2}(g)$ 和 $Cl_{2}(g)$ 的相对能量为 0。下列说法错误的是(
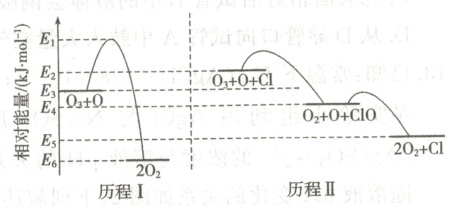
A.$E_{6}-E_{3}=E_{5}-E_{2}$
B.$Cl—Cl$ 键能为 $2(E_{2}-E_{3})kJ· mol^{-1}$
C.相同条件下,$O_{3}$ 的平衡转化率:历程 $I$ =历程 $II$
D.历程 $I$ 和 $II$ 中速率最快的一步反应的热化学方程式为 $ClO(g)+O(g)\xlongequal{}O_{2}(g)+Cl(g)$ $\Delta H=(E_{4}-E_{5})kJ· mol^{-1}$
D
)
A.$E_{6}-E_{3}=E_{5}-E_{2}$
B.$Cl—Cl$ 键能为 $2(E_{2}-E_{3})kJ· mol^{-1}$
C.相同条件下,$O_{3}$ 的平衡转化率:历程 $I$ =历程 $II$
D.历程 $I$ 和 $II$ 中速率最快的一步反应的热化学方程式为 $ClO(g)+O(g)\xlongequal{}O_{2}(g)+Cl(g)$ $\Delta H=(E_{4}-E_{5})kJ· mol^{-1}$
答案:
8. D [由图可知,${Cl}$原子是历程Ⅱ的催化剂,催化剂不能改变反应的反应热,则历程Ⅰ、Ⅱ的反应热相等,即$\Delta H=E_{6}-E_{3}=E_{5}-E_{2}$,A正确;${Cl_{2}(g)}$的相对能量为0,由图可知${Cl(g)}$的相对能量为$(E_{2}-E_{3})\ kJ·mol^{-1}$,断裂化学键吸收热量,${Cl_{2}(g)\to 2Cl(g)}$吸收能量为$2(E_{2}-E_{3})\ kJ· mol^{-1}$,则${Cl-Cl}$键能为$2(E_{2}-E_{3})\ kJ· mol^{-1}$,B正确;催化剂不能改变反应的始态和终态,不能改变反应物的平衡转化率,即相同条件下${O_{3}}$的平衡转化率:历程Ⅱ$=$历程Ⅰ,C正确;由图可知,历程Ⅱ中第二步反应的活化能小于第一步反应的活化能,反应的活化能越低,反应速率越快,则历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为${ClO(g) + O(g)\xlongequal{}O_{2}(g) + Cl(g)}$ $\Delta H=(E_{5}-E_{4})\ kJ· mol^{-1}$,D错误。]
9. 石棉尾矿中主要含有 $Z_{3}(W_{2}Y_{5})(YX)_{4}$,$Z_{3}(W_{2}Y_{5})(YX)_{4}$ 可用作润滑油添加剂。其中 $X、Y、Z、W$ 为原子序数依次增大的短周期主族元素;$X$ 的原子半径在周期表中最小;$Y$ 的 $p$ 轨道上自旋方向不同的电子数之比为 $3:1$;$W$ 是地壳中含量第二的元素。下列说法正确的是(
A.离子半径:$r(Z)>r(Y)$
B.$Y$ 和 $W$ 形成的化合物不与酸反应
C.$X$ 和 $Z$ 形成的化合物能与水反应生成一种不溶物和气体
D.$X$ 和 $Y$ 两元素形成的化合物中,一定不含非极性键
C
)A.离子半径:$r(Z)>r(Y)$
B.$Y$ 和 $W$ 形成的化合物不与酸反应
C.$X$ 和 $Z$ 形成的化合物能与水反应生成一种不溶物和气体
D.$X$ 和 $Y$ 两元素形成的化合物中,一定不含非极性键
答案:
9. C [Y是${O}$,Z是${Mg}$,则离子半径:$r({O^{2-}})>r({Mg^{2+}})$,A错误;Y是${O}$,W是${Si}$,二者形成的化合物为${SiO_{2}}$,${SiO_{2}}$能与氢氟酸反应,B错误;X是${H}$,Z是${Mg}$,二者形成的化合物为${MgH_{2}}$,${MgH_{2}}$与水反应生成${Mg(OH)_{2}}$和${H_{2}}$,C正确;X是${H}$,Y是${O}$,二者形成的化合物有${H_{2}O}$和${H_{2}O_{2}}$,${H_{2}O_{2}}$中含有非极性键,D错误。]
10. 水系锌锰二次电池放电时存在电极 $MnO_{2}$ 剥落现象,造成电池容量衰减。研究发现,加入少量 $KI$ 固体能很大程度恢复“损失”的容量,原理如图。已知 PBS 膜只允许 $Zn^{2+}$ 通过。下列说法错误的是(
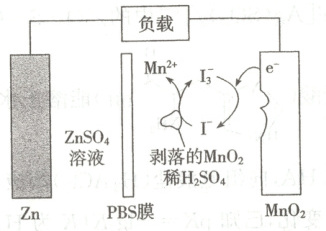
A.放电时,$0.6\ mol\ I^{-}$ 参加反应,理论上负极减少 $13\ g$
B.充电时,电路中每通过 $2\ mol\ e^{-}$,阳极区溶液减少 $87\ g$
C.放电时的总反应:$Zn+MnO_{2}+4H^{+}\xlongequal{}Zn^{2+}+Mn^{2+}+2H_{2}O$
D.PBS 膜的优点是能有效抑制电池的自放电
B
)
A.放电时,$0.6\ mol\ I^{-}$ 参加反应,理论上负极减少 $13\ g$
B.充电时,电路中每通过 $2\ mol\ e^{-}$,阳极区溶液减少 $87\ g$
C.放电时的总反应:$Zn+MnO_{2}+4H^{+}\xlongequal{}Zn^{2+}+Mn^{2+}+2H_{2}O$
D.PBS 膜的优点是能有效抑制电池的自放电
答案:
10. B [加入${KI}$后,${I^{-}}$与剥落的${MnO_{2}}$反应生成${I^{-}_{3}}$,发生反应为${MnO_{2} + 3I^{-} + 4H^{+}\xlongequal{}Mn^{2+} + I^{-}_{3} + 2H_{2}O}$、${I^{-}_{3} + 2e^{-}\xlongequal{}3I^{-}}$,如有0.6 mol ${I^{-}}$参加反应,需得到电子0.4 mol,理论上负极${Zn}$减少0.2 mol,质量为13 g,A正确;充电时阳极电极反应式为${3I^{-} - 2e^{-}\xlongequal{}I^{-}_{3}}$、${Mn^{2+} + 2H_{2}O - 2e^{-}\xlongequal{}}{MnO_{2} + 4H^{+}}$,电路中每通过2 mol ${e^{-}}$,阳极区溶液减少的质量小于1 mol ${MnO_{2}}$的质量,即小于87 g,B错误;${Zn}$电极为负极,发生氧化反应${Zn - 2e^{-}\xlongequal{}Zn^{2+}}$,${MnO_{2}}$为正极,发生还原反应${MnO_{2} + 2e^{-} + 4H^{+}\xlongequal{}Mn^{2+} + 2H_{2}O}$,放电时的总反应为${MnO_{2} + Zn + 4H^{+}\xlongequal{}Zn^{2+} + Mn^{2+} + 2H_{2}O}$,C正确;PBS膜能够防止脱落的二氧化锰与锌接触构成微电池,减少锌的损耗,能有效抑制电池的自放电,D正确。]
11. 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器)(

B
)
答案:
11. B [配制溶液需用量筒量取浓硝酸,A选项中缺少量筒,故A错误;锥形瓶可用于物质反应,分液漏斗控制硫酸加入,注射器中收集气体,量筒量取硫酸,计时器记录时间,烧杯可能用于临时盛放试剂,仪器和试剂均满足实验需求,故B正确;干燥氨气应使用碱石灰,无水氯化钙会与氨气发生络合反应,因此不能用无水氯化钙干燥氨气,故C错误;实验室制备乙炔用碳化钙和饱和食盐水,乙炔制备通常不使用启普发生器,因为反应剧烈且生成物易堵塞仪器,故D错误。]
查看更多完整答案,请扫码查看


