2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
11. 下列由实验操作及现象所得的结论正确的是(
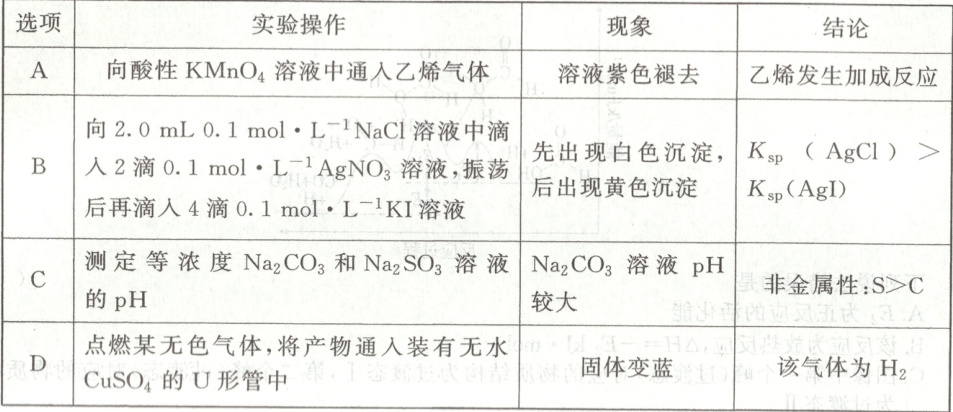
B
)
答案:
11. B [酸性高锰酸钾溶液可氧化乙烯,紫色褪去,为氧化反应,A 错误;${AgNO_{3}}$溶液不足,发生沉淀的转化,${AgCl}$转化为更难溶的${AgI}$,则$K_{sp}({AgCl}) > K_{sp}({AgI})$,B 正确;${Na_{2}SO_{3}}$溶液对应的酸不是最高价含氧酸,由实验操作和现象,不能比较 S、C 的非金属性强弱,C 错误;无水${CuSO_{4}}$变蓝,可知气体燃烧有水生成,则气体中一定含 H 元素,可能为氢气、甲烷等,D 错误。]
12. 离子液体$[Amim]BF_{4}$的合成路线为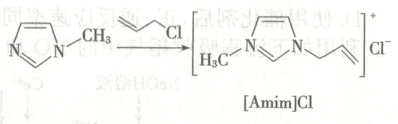
 ,下列叙述错误的是(
,下列叙述错误的是(
A. 的名称为3-氯-1-丙烯
的名称为3-氯-1-丙烯
B.$[Amim]Cl$中含有共价键和离子键
C.$NaBF_{4}$的电子式为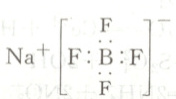
D.$[Amim]BF_{4}$可作为电解质用于电池中
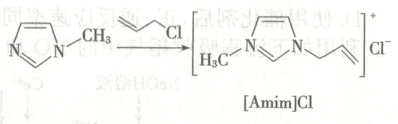
 ,下列叙述错误的是(
,下列叙述错误的是(C
)A.
 的名称为3-氯-1-丙烯
的名称为3-氯-1-丙烯B.$[Amim]Cl$中含有共价键和离子键
C.$NaBF_{4}$的电子式为
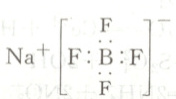
D.$[Amim]BF_{4}$可作为电解质用于电池中
答案:
12. C
13. 工业上用乙苯与$CO_{2}$生产苯乙烯,主要反应:
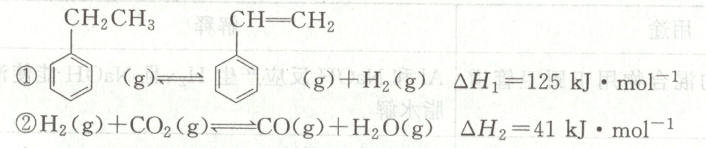
在一定压强和催化剂作用下,向恒容容器中充入等物质的量的乙苯和$CO_{2}$。达到平衡时,各物质的体积分数随温度的变化如图所示。下列说法不正确的是(
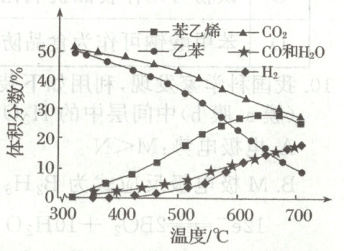
A.用液化的方法除去水,有利于提高苯乙烯的平衡转化率
B.苯乙烯和$H_{2}$的体积分数变化差异的主要原因是$CO_{2}$消耗$H_{2}$
C.乙苯的平衡转化率随温度升高而升高,宜采用$700^{\circ}C$获得更多的苯乙烯
D.当反应混合气体的平均相对分子质量不再变化时,反应达到化学平衡状态
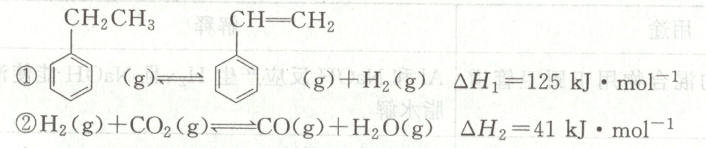
在一定压强和催化剂作用下,向恒容容器中充入等物质的量的乙苯和$CO_{2}$。达到平衡时,各物质的体积分数随温度的变化如图所示。下列说法不正确的是(
C
)
A.用液化的方法除去水,有利于提高苯乙烯的平衡转化率
B.苯乙烯和$H_{2}$的体积分数变化差异的主要原因是$CO_{2}$消耗$H_{2}$
C.乙苯的平衡转化率随温度升高而升高,宜采用$700^{\circ}C$获得更多的苯乙烯
D.当反应混合气体的平均相对分子质量不再变化时,反应达到化学平衡状态
答案:
13. C [用液化水的方式除去水,反应②正向移动消耗${H_{2}}$,反应①正向移动,有利于提高乙苯的平衡转化率,A 正确;发生反应①生成的苯乙烯和氢气的体积相等,相同温度时,苯乙烯的体积分数大于氢气的体积分数,说明氢气与二氧化碳发生反应②而被消耗,B 正确;由图像可知,温度升高到$630\ ^{\circ}C$左右时,苯乙烯的体积分数较大;温度继续升高,采用$700\ ^{\circ}C$获得更多的苯乙烯,苯乙烯的体积分数变化不明显,但耗能较大,故宜采用$630\ ^{\circ}C$获得较多的苯乙烯,C 错误;在恒容容器中发生反应①、②,只有气体物质反应及生成,混合气体的质量不变,反应①是气体分子数增大的反应,随反应的进行,气体的物质的量增加,混合气体的平均相对分子质量$M = \frac{m}{n}$减小,当混合气体的平均相对分子质量不再变化时,反应达到平衡状态,D 正确。]
14. $25^{\circ}C$时,用HCl气体调节$0.10\ mol·L^{-1}$氨水的pH,溶液中微粒浓度的对数值($lg\ c$)、反应物的物质的量之比$x=\frac{n(HCl)}{n(NH_{3}·H_{2}O)}$与pH的关系如图所示,若忽略通入气体后溶液体积的变化,下列说法正确的是(
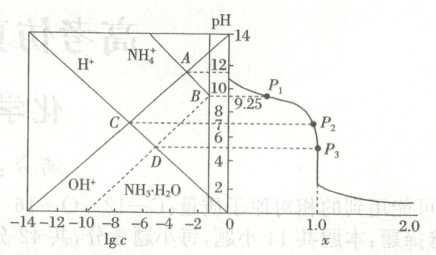
A.$P_{1}$点对应x的值大于0.5
B.D点所示溶液中$c(NH^{+}_{4})$是C点的2倍
C.$25^{\circ}C$时,溶液中水的电离程度:$P_{1}>P_{2}>P_{3}$
D.$P_{2}$点所示溶液中:$c(NH_{3}·H_{2}O)=\frac{1}{10+10^{3.25}}\ mol·L^{-1}$
D
)
A.$P_{1}$点对应x的值大于0.5
B.D点所示溶液中$c(NH^{+}_{4})$是C点的2倍
C.$25^{\circ}C$时,溶液中水的电离程度:$P_{1}>P_{2}>P_{3}$
D.$P_{2}$点所示溶液中:$c(NH_{3}·H_{2}O)=\frac{1}{10+10^{3.25}}\ mol·L^{-1}$
答案:
14. D [由图可知,$P_{1}$对应溶液中铵根离子和一水合氨的浓度相同、${pH}$为 9.25,$c({NH^{+}_{4}}) = c({NH_{3}· H_{2}O})$,根据物料守恒:$c({NH^{+}_{4}}) + c({NH_{3}· H_{2}O}) = 0.1\ mol·L^{-1}$得$c({NH^{+}_{4}}) = c({NH_{3}· H_{2}O}) = 0.05\ mol·L^{-1}$,根据电荷守恒:$c({Cl^{-}}) + c({OH^{-}}) = c({NH^{+}_{4}}) + c({H^{+}})$,$c({OH^{-}}) > c({H^{+}})$,则$c({Cl^{-}}) < c({NH^{+}_{4}}) = 0.05\ mol·L^{-1}$,则$x = \frac{n({HCl})}{n({NH_{3}· H_{2}O})} < 0.5$,A 错误;D 点是氯化铵溶液,C 点是氯化铵和一水合氨的混合物,且氯化铵更多一些(C 点两者相等),则 D 点所示溶液中$c({NH^{+}_{4}})$小于 C 点的 2 倍,B 错误;氨水在溶液中电离出的氢氧根离子抑制水的电离,铵根离子在溶液中水解促进水的电离,由分析可知,$P_{1}$、$P_{2}$、$P_{3}$时溶液中铵根离子浓度依次增大,水的电离程度依次增大,C 错误;$K_{b} = \frac{c({NH^{+}_{4}})· c({OH^{-}})}{c({NH_{3}· H_{2}O})} = 10^{-4.75}$,$P_{2}$所示溶液${pH} = 7$,则$c({OH^{-}}) = 10^{-7}\ mol·L^{-1}$,所以$\frac{c({NH^{+}_{4}})}{c({NH_{3}· H_{2}O})} = \frac{10^{-4.75}}{10^{-7}} = 10^{2.25}$,根据物料守恒$c({NH^{+}_{4}}) + c({NH_{3}· H_{2}O}) = 0.1\ mol·L^{-1}$,则$\frac{c({NH^{+}_{4}})}{c({NH_{3}· H_{2}O})} = \frac{0.1 - c({NH_{3}· H_{2}O})}{c({NH_{3}· H_{2}O})} = 10^{2.25}$,则$c({NH_{3}· H_{2}O}) = \frac{1}{10 + 10^{3.25}}\ mol·L^{-1}$,D 正确。]
查看更多完整答案,请扫码查看


