2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15. (16 分)一种以钌矿石[主要含 Ru(CO₃)₂,还含少量的 Al₂O₃、FeO、MgO、SiO₂ 和 CaO 等]为原料制备钌(Ru)的流程如图,回答下列问题:
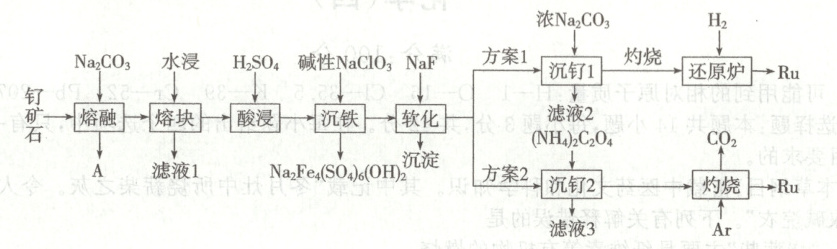
已知:①常温下,Ksp(CaF₂) = 1.5×10⁻¹⁰,Ksp(MgF₂) = 7.4×10⁻¹¹,$\sqrt{7.4} \approx 2.7$,$\sqrt{15} \approx 3.9$;
②离子浓度等于或低于 1×10⁻⁵ mol·L⁻¹时,则认为该离子已被完全除去。
(1)气体 A 的成分为
(2)“沉铁”的离子方程式为
(3)“软化”时,溶液中钙离子和镁离子的浓度分别为 0.01 mol·L⁻¹和 0.02 mol·L⁻¹,常温下取 2.0 L 该滤液,使其中 Ca²⁺、Mg²⁺沉淀完全,则至少需要加入 NaF 的物质的量为
(4)“灼烧”时 Ar 的作用是
(5)产生相同量的钌,方案 1 中消耗 H₂与方案 2 中产生 CO₂的物质的量比值为

已知:①常温下,Ksp(CaF₂) = 1.5×10⁻¹⁰,Ksp(MgF₂) = 7.4×10⁻¹¹,$\sqrt{7.4} \approx 2.7$,$\sqrt{15} \approx 3.9$;
②离子浓度等于或低于 1×10⁻⁵ mol·L⁻¹时,则认为该离子已被完全除去。
(1)气体 A 的成分为
CO₂
,滤液 1 中溶质为Na₂SiO₃、Na[Al(OH)₄]
。(2)“沉铁”的离子方程式为
6Na⁺ + 12Fe²⁺ + 2ClO₃⁻ + 18SO₄²⁻ + 6H₂O = 3Na₂Fe₄(SO₄)₆(OH)₂↓ + 2Cl⁻ + 6OH⁻
。(3)“软化”时,溶液中钙离子和镁离子的浓度分别为 0.01 mol·L⁻¹和 0.02 mol·L⁻¹,常温下取 2.0 L 该滤液,使其中 Ca²⁺、Mg²⁺沉淀完全,则至少需要加入 NaF 的物质的量为
0.1278 mol
。(4)“灼烧”时 Ar 的作用是
作保护气,防止钌与空气中的氧气反应
。(5)产生相同量的钌,方案 1 中消耗 H₂与方案 2 中产生 CO₂的物质的量比值为
1:2
;从安全角度分析,方案 2 优于方案 1,其理由是方案1使用氢气作还原剂,氢气是易燃易爆气体,方案2更安全
。
答案:
15.解析
(1)$A$为${CO_{2}}$,滤液$1$中溶质为${Na_{2}SiO_{3}}$、${Na[Al(OH)_{4}]}$。
(2)“沉铁”时,氯酸钠在碱性条件下把二价铁转化为三价铁并生成${Na_{2}Fe_{4}(SO_{4})_{6}(OH)_{2}}$沉淀,离子方程式为${6Na^{+} + 12Fe^{2+} + 2ClO^{-}_{3} + 18SO^{2-}_{4} + 6H_{2}O\xlongequal{}3Na_{2}Fe_{4}(SO_{4})_{6}(OH)_{2}\downarrow + 2Cl^{-} + 6OH^{-}}$。
(3)$K_{sp}{(MgF_{2})} = 7.4× 10^{-11}$比$K_{sp}{(CaF_{2})} = 1.5× 10^{-10}$更小,说明${Mg^{2+}}$先沉淀完全,故以${Ca^{2+}}$完全沉淀计算,$K_{sp}{(CaF_{2})} = 1.5× 10^{-10} = c{(Ca^{2+})}× c^{2}{(F^{-})}$,当$c{(Ca^{2+})} = 1× 10^{-5}\ mol· L^{-1}$时,$c{(F^{-})} = \sqrt{15}× 10^{-3}\ mol· L^{-1} \approx 3.9× 10^{-3}\ mol· L^{-1}$,则加上沉淀的氟离子,需加入${NaF}$的物质的量为$(0.01\ mol· L^{-1}× 2 + 0.02\ mol· L^{-1}× 2)× 2.0\ L + 3.9× 10^{-3}\ mol× 2 = 0.1278\ mol$。
(4)“灼烧”时,方案$1$中有还原性的${H_{2}}$,未加入${Ar}$,方案$2$加了${Ar}$,故${Ar}$的作用是作保护气,防止钌与空气中的氧气反应。
(5)${Ru}$从$+2$价变为$0$价,每生成$1\ mol\ {Ru}$,需要${H_{2}}\ 1\ mol$,分解产生${CO_{2}}\ 2\ mol$,方案$1$中消耗${H_{2}}$与方案$2$中产生${CO_{2}}$的物质的量比值为$1:2$,从安全角度分析,方案$2$优于方案$1$,原因是方案$1$使用氢气作还原剂,氢气是易燃易爆气体,方案$2$更安全。
答案
(1)${CO_{2}}$ ${Na_{2}SiO_{3}}$、${Na[Al(OH)_{4}]}$
(2)6Na⁺ + 12Fe²⁺ + 2ClO₃⁻ + 18SO₄²⁻ + 6H₂O = 3Na₂Fe₄(SO₄)₆(OH)₂↓ + 2Cl⁻ + 6OH⁻
(3)$0.1278\ mol$
(4)作保护气,防止钌与空气中的氧气反应
(5)$1:2$ 方案$1$使用氢气作还原剂,氢气是易燃易爆气体,方案$2$更安全
(1)$A$为${CO_{2}}$,滤液$1$中溶质为${Na_{2}SiO_{3}}$、${Na[Al(OH)_{4}]}$。
(2)“沉铁”时,氯酸钠在碱性条件下把二价铁转化为三价铁并生成${Na_{2}Fe_{4}(SO_{4})_{6}(OH)_{2}}$沉淀,离子方程式为${6Na^{+} + 12Fe^{2+} + 2ClO^{-}_{3} + 18SO^{2-}_{4} + 6H_{2}O\xlongequal{}3Na_{2}Fe_{4}(SO_{4})_{6}(OH)_{2}\downarrow + 2Cl^{-} + 6OH^{-}}$。
(3)$K_{sp}{(MgF_{2})} = 7.4× 10^{-11}$比$K_{sp}{(CaF_{2})} = 1.5× 10^{-10}$更小,说明${Mg^{2+}}$先沉淀完全,故以${Ca^{2+}}$完全沉淀计算,$K_{sp}{(CaF_{2})} = 1.5× 10^{-10} = c{(Ca^{2+})}× c^{2}{(F^{-})}$,当$c{(Ca^{2+})} = 1× 10^{-5}\ mol· L^{-1}$时,$c{(F^{-})} = \sqrt{15}× 10^{-3}\ mol· L^{-1} \approx 3.9× 10^{-3}\ mol· L^{-1}$,则加上沉淀的氟离子,需加入${NaF}$的物质的量为$(0.01\ mol· L^{-1}× 2 + 0.02\ mol· L^{-1}× 2)× 2.0\ L + 3.9× 10^{-3}\ mol× 2 = 0.1278\ mol$。
(4)“灼烧”时,方案$1$中有还原性的${H_{2}}$,未加入${Ar}$,方案$2$加了${Ar}$,故${Ar}$的作用是作保护气,防止钌与空气中的氧气反应。
(5)${Ru}$从$+2$价变为$0$价,每生成$1\ mol\ {Ru}$,需要${H_{2}}\ 1\ mol$,分解产生${CO_{2}}\ 2\ mol$,方案$1$中消耗${H_{2}}$与方案$2$中产生${CO_{2}}$的物质的量比值为$1:2$,从安全角度分析,方案$2$优于方案$1$,原因是方案$1$使用氢气作还原剂,氢气是易燃易爆气体,方案$2$更安全。
答案
(1)${CO_{2}}$ ${Na_{2}SiO_{3}}$、${Na[Al(OH)_{4}]}$
(2)6Na⁺ + 12Fe²⁺ + 2ClO₃⁻ + 18SO₄²⁻ + 6H₂O = 3Na₂Fe₄(SO₄)₆(OH)₂↓ + 2Cl⁻ + 6OH⁻
(3)$0.1278\ mol$
(4)作保护气,防止钌与空气中的氧气反应
(5)$1:2$ 方案$1$使用氢气作还原剂,氢气是易燃易爆气体,方案$2$更安全
16. (14 分)铬酰氯(CrO₂Cl₂,M = 155 g·mol⁻¹)为深红棕色液体,沸点为 117℃,易挥发、易水解。在有机合成领域中有着重要用途。铬酰氯制备方法之一是重铬酸钾法,其制备操作步骤如下:
①如图连接好装置,检查气密性,装入药品;
②向 14.7 g K₂Cr₂O₇(M = 294 g·mol⁻¹)与 29.8 g KCl 混合粉末中滴入浓硫酸,控温 10℃,充分反应;
③一系列操作……;
④用 D 装置收集铬酰氯。
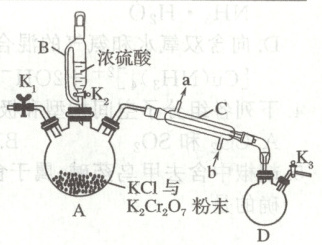
回答下列问题:
(1)C 装置的名称是
(2)该制备的反应机理为:浓硫酸先与氯化钾反应生成 HCl 气体,HCl 再与 K₂Cr₂O₇反应生成铬酰氯。写出 HCl 与 K₂Cr₂O₇反应生成铬酰氯的化学方程式:
(3)步骤②控温 10℃,也可改为先将浓硫酸在反应前放入冰箱中冷却至 0℃左右,这是为了防止
(4)步骤③“一系列操作”(开关的开闭略去)包括下列操作,其操作顺序为
①通入 CO₂至 D 装置液面不再上升
②加热 A 装置至 117℃
③通入 N₂,排尽空气
④通冷却水
(5)收集 117℃左右的馏分时发现 D 中充满红棕色气体,几乎没有收集到液体,请改进装置:
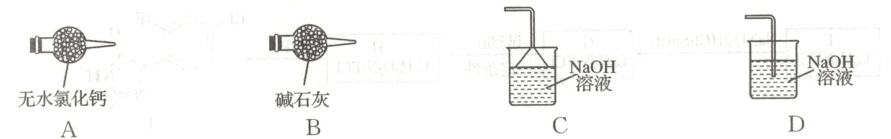
(6)图中缺少尾气处理装置,下图所示的尾气处理装置中最合理的是
(7)本实验的产率为 80.0%,则制得的铬酰氯(CrO₂Cl₂)的质量为
①如图连接好装置,检查气密性,装入药品;
②向 14.7 g K₂Cr₂O₇(M = 294 g·mol⁻¹)与 29.8 g KCl 混合粉末中滴入浓硫酸,控温 10℃,充分反应;
③一系列操作……;
④用 D 装置收集铬酰氯。

回答下列问题:
(1)C 装置的名称是
直形冷凝管
;该实验中浓硫酸除了作反应物,还有一个重要作用是吸水剂
。(2)该制备的反应机理为:浓硫酸先与氯化钾反应生成 HCl 气体,HCl 再与 K₂Cr₂O₇反应生成铬酰氯。写出 HCl 与 K₂Cr₂O₇反应生成铬酰氯的化学方程式:
K₂Cr₂O₇ + 6HCl = 2CrO₂Cl₂ + 2KCl + 3H₂O
。(3)步骤②控温 10℃,也可改为先将浓硫酸在反应前放入冰箱中冷却至 0℃左右,这是为了防止
反应温度过高,反应速率过快,同时防止产生的HCl挥发
。(4)步骤③“一系列操作”(开关的开闭略去)包括下列操作,其操作顺序为
③④②①
(填序号)。①通入 CO₂至 D 装置液面不再上升
②加热 A 装置至 117℃
③通入 N₂,排尽空气
④通冷却水
(5)收集 117℃左右的馏分时发现 D 中充满红棕色气体,几乎没有收集到液体,请改进装置:
将装置D置于冰水浴
。(6)图中缺少尾气处理装置,下图所示的尾气处理装置中最合理的是
B
(填字母)。
(7)本实验的产率为 80.0%,则制得的铬酰氯(CrO₂Cl₂)的质量为
12.4 g
。
答案:
16.解析
(1)$C$装置是用于冷凝的直形冷凝管;铬酰氯遇水要水解,反应中也会生成一定量的水,故需要吸水剂,所以浓硫酸同时吸收反应体系的水。
(2)根据信息,${HCl}$与${K_{2}Cr_{2}O_{7}}$反应生成铬酰氯的化学方程式为${K_{2}Cr_{2}O_{7} + 6HCl\xlongequal{}2CrO_{2}Cl_{2} + 2KCl + 3H_{2}O}$。
(3)反应温度仅$10\ ^{\circ}C$,铬酰氯挥发的温度是$117\ ^{\circ}C$,故不是为了防止它的挥发,题中也未涉及副反应或催化剂等,所以低温是为了防止温度偏高,反应速率过快,同时考虑生成的${HCl}$易挥发。
(4)从给的四步操作可以确定需先排出空气,防止后续反应体系中有水使铬酰氯水解;加热前需要先通冷却水;反应结束需要再鼓气将导管中的铬酰氯全部鼓入$D$装置,故排序为③④②①。
(5)装置中充满红棕色气体,说明水未能将铬酰氯蒸气冷凝,冰水浴温度较低,可使铬酰氯蒸气液化并减少液态铬酰氯的挥发,所以需要将$D$装置置于冰水浴。
(6)碱石灰可吸收未反应的氯化氢气体和未冷凝的铬酰氯蒸气,并可防止空气中的水蒸气进入装置,故选B。
(7)利用反应${K_{2}Cr_{2}O_{7} + 6HCl\xlongequal{}2CrO_{2}Cl_{2} + 2KCl + 3H_{2}O}$,可得${CrO_{2}Cl_{2}}$的质量为$\dfrac{14.7\ g}{294\ g/mol}× 2× 155\ g/mol× 80\% = 12.4\ g$。
答案
(1)直形冷凝管 吸水剂
(2)${K_{2}Cr_{2}O_{7} + 6HCl\xlongequal{}2CrO_{2}Cl_{2} + 2KCl + 3H_{2}O}$
(3)反应温度过高,反应速率过快,同时防止产生的${HCl}$挥发
(4)③④②①
(5)将装置$D$置于冰水浴
(6)B
(7)$12.4\ g$
(1)$C$装置是用于冷凝的直形冷凝管;铬酰氯遇水要水解,反应中也会生成一定量的水,故需要吸水剂,所以浓硫酸同时吸收反应体系的水。
(2)根据信息,${HCl}$与${K_{2}Cr_{2}O_{7}}$反应生成铬酰氯的化学方程式为${K_{2}Cr_{2}O_{7} + 6HCl\xlongequal{}2CrO_{2}Cl_{2} + 2KCl + 3H_{2}O}$。
(3)反应温度仅$10\ ^{\circ}C$,铬酰氯挥发的温度是$117\ ^{\circ}C$,故不是为了防止它的挥发,题中也未涉及副反应或催化剂等,所以低温是为了防止温度偏高,反应速率过快,同时考虑生成的${HCl}$易挥发。
(4)从给的四步操作可以确定需先排出空气,防止后续反应体系中有水使铬酰氯水解;加热前需要先通冷却水;反应结束需要再鼓气将导管中的铬酰氯全部鼓入$D$装置,故排序为③④②①。
(5)装置中充满红棕色气体,说明水未能将铬酰氯蒸气冷凝,冰水浴温度较低,可使铬酰氯蒸气液化并减少液态铬酰氯的挥发,所以需要将$D$装置置于冰水浴。
(6)碱石灰可吸收未反应的氯化氢气体和未冷凝的铬酰氯蒸气,并可防止空气中的水蒸气进入装置,故选B。
(7)利用反应${K_{2}Cr_{2}O_{7} + 6HCl\xlongequal{}2CrO_{2}Cl_{2} + 2KCl + 3H_{2}O}$,可得${CrO_{2}Cl_{2}}$的质量为$\dfrac{14.7\ g}{294\ g/mol}× 2× 155\ g/mol× 80\% = 12.4\ g$。
答案
(1)直形冷凝管 吸水剂
(2)${K_{2}Cr_{2}O_{7} + 6HCl\xlongequal{}2CrO_{2}Cl_{2} + 2KCl + 3H_{2}O}$
(3)反应温度过高,反应速率过快,同时防止产生的${HCl}$挥发
(4)③④②①
(5)将装置$D$置于冰水浴
(6)B
(7)$12.4\ g$
查看更多完整答案,请扫码查看


