2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
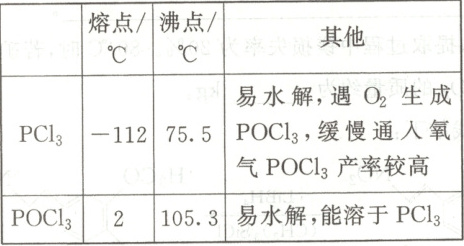
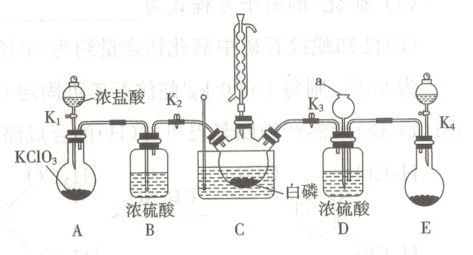
16. (14分)三氯氧磷($POCl_{3}$)俗名磷酰氯,可用作半导体掺杂剂及光导纤维原料,是能推进中国半导体产业链发展壮大的一种重要的化工原料。工业上可以直接氧化$PCl_{3}$制备$POCl_{3}$。某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去),部分物质的性质如下表:
回答下列问题:
(1)制备$POCl_{3}$时进行操作:(ⅰ)连接仪器,检查装置气密性;(ⅱ)……,至C中白磷消失;(ⅲ)……,控制C装置反应温度在60~65$^{\circ}C$,最终制得$POCl_{3}$产品。操作(ⅱ)为
(2)已知电负性$O>Cl>P$,$POCl_{3}$在过量NaOH溶液中发生反应的离子方程式为
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素的含量,实验步骤如下:
①取$m\ g$产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
②向锥形瓶中加入$0.100\ 0\ mol·L^{-1}$的$AgNO_{3}$溶液50.00 mL,使$Cl^{-}$完全沉淀;
③向其中加入2 mL硝基苯,用力摇动使沉淀表面被有机物覆盖;
④加入$NH_{4}Fe(SO_{4})_{2}$作指示剂用$c\ mol·L^{-1}\ NH_{4}SCN$溶液滴定过量$Ag^{+}$至终点,记下所用体积为$V\ mL$。
标志滴定终点的现象是


回答下列问题:
(1)制备$POCl_{3}$时进行操作:(ⅰ)连接仪器,检查装置气密性;(ⅱ)……,至C中白磷消失;(ⅲ)……,控制C装置反应温度在60~65$^{\circ}C$,最终制得$POCl_{3}$产品。操作(ⅱ)为
打开K1、K2,关闭K3、K4
,步骤(ⅲ)控制温度60~65$^{\circ}C$,其主要目的是加快反应速率,防止PCl3汽化
。该实验装置存在一处明显的设计缺陷,改进方法是在球形冷凝管上端连接一个装有碱石灰的干燥管
。(2)已知电负性$O>Cl>P$,$POCl_{3}$在过量NaOH溶液中发生反应的离子方程式为
$POCl3 + 6OH- → PO4^3- + 3Cl- + 3H2O$
。(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素的含量,实验步骤如下:
①取$m\ g$产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
②向锥形瓶中加入$0.100\ 0\ mol·L^{-1}$的$AgNO_{3}$溶液50.00 mL,使$Cl^{-}$完全沉淀;
③向其中加入2 mL硝基苯,用力摇动使沉淀表面被有机物覆盖;
④加入$NH_{4}Fe(SO_{4})_{2}$作指示剂用$c\ mol·L^{-1}\ NH_{4}SCN$溶液滴定过量$Ag^{+}$至终点,记下所用体积为$V\ mL$。
标志滴定终点的现象是
滴入最后半滴标准液,溶液变为浅红色,且半分钟内不褪色
,$Cl$元素的质量分数为$\frac{(5 - cV)× 35.5× 10^{-3}}{m}× 100\%$或$\frac{3.55(5 - cV)}{m}\%$
(用含$m$、$c$、$V$的表达式表示),步骤①若不加入稀硝酸,所测Cl元素含量将会偏大
(填“偏大”“偏小”或“不变”)。
答案:
16. 解析
(1)仪器气密性检查,没有问题后,可以开始实验,使氯气进入装置 C,则操作(ⅱ)为打开$K_{1}$、$K_{2}$,关闭$K_{3}$、$K_{4}$;根据题中信息可知,${PCl_{3}}$沸点较低,则控制温度$60\sim 65\ ^{\circ}C$,其主要目的是加快反应速率,防止${PCl_{3}}$汽化;该实验过程使用了有毒的氯气,需有尾气处理装置,则改进方法是在球形冷凝管上端连接一个装有碱石灰的干燥管。
(2)根据题给信息可知,${POCl_{3}}$易水解,且电负性${O > Cl > P}$,则${POCl_{3}}$中 P 为 + 5 价,其水解方程式为${POCl_{3} + 3H_{2}O\xlongequal{}H_{3}PO_{4} + 3HCl}$,则${POCl_{3}}$在过量${NaOH}$溶液中发生反应的离子方程式为${POCl_{3} + 6OH^{-}\xlongequal{}PO^{3 - }_{4} + 3Cl^{-} + 3H_{2}O}$。
(3)用$c\ mol·L^{-1}{NH_{4}SCN}$溶液滴定过量${Ag^{+}}$至终点,当滴定达到终点时${NH_{4}SCN}$过量,${Fe^{3 + }}$与${SCN^{-}}$反应溶液会变红色,半分钟内不褪色,即可确定滴定终点。用$c\ mol·L^{-1}{NH_{4}SCN}$溶液滴定过量${Ag^{+}}$至终点,记下所用体积$V\ mL$,则过量${Ag^{+}}$的物质的量为$cV× 10^{-3}\ mol$,与${Cl^{-}}$反应的${Ag^{+}}$的物质的量为$0.1000\ mol·L^{-1}× 0.05\ L - cV× 10^{-3}\ mol = (5 - cV)× 10^{-3}\ mol$,${Cl}$元素的质量分数为$\frac{(5 - cV)× 10^{-3}\ mol× 35.5\ g·mol^{-1}}{m\ g}× 100\% = \frac{(5 - cV)× 35.5× 10^{-3}}{m}× 100\%$。步骤①若不加入稀硝酸,则其中过量的氢氧化钠可以和硝酸银反应生成沉淀,则被消耗的硝酸银偏多,则所测${Cl}$元素含量将会偏大。
答案
(1)打开$K_{1}$、$K_{2}$,关闭$K_{3}$、$K_{4}$ 加快反应速率,防止${PCl_{3}}$汽化 在球形冷凝管上端连接一个装有碱石灰的干燥管
(2)${POCl_{3} + 6OH^{-}\xlongequal{}PO^{3 - }_{4} + 3Cl^{-} + 3H_{2}O}$
(3)滴入最后半滴标准液,溶液变为浅红色,且半分钟内不褪色 $\frac{(5 - cV)× 35.5× 10^{-3}}{m}× 100\%$或$\frac{3.55(5 - cV)}{m}\%$ 偏大
(1)仪器气密性检查,没有问题后,可以开始实验,使氯气进入装置 C,则操作(ⅱ)为打开$K_{1}$、$K_{2}$,关闭$K_{3}$、$K_{4}$;根据题中信息可知,${PCl_{3}}$沸点较低,则控制温度$60\sim 65\ ^{\circ}C$,其主要目的是加快反应速率,防止${PCl_{3}}$汽化;该实验过程使用了有毒的氯气,需有尾气处理装置,则改进方法是在球形冷凝管上端连接一个装有碱石灰的干燥管。
(2)根据题给信息可知,${POCl_{3}}$易水解,且电负性${O > Cl > P}$,则${POCl_{3}}$中 P 为 + 5 价,其水解方程式为${POCl_{3} + 3H_{2}O\xlongequal{}H_{3}PO_{4} + 3HCl}$,则${POCl_{3}}$在过量${NaOH}$溶液中发生反应的离子方程式为${POCl_{3} + 6OH^{-}\xlongequal{}PO^{3 - }_{4} + 3Cl^{-} + 3H_{2}O}$。
(3)用$c\ mol·L^{-1}{NH_{4}SCN}$溶液滴定过量${Ag^{+}}$至终点,当滴定达到终点时${NH_{4}SCN}$过量,${Fe^{3 + }}$与${SCN^{-}}$反应溶液会变红色,半分钟内不褪色,即可确定滴定终点。用$c\ mol·L^{-1}{NH_{4}SCN}$溶液滴定过量${Ag^{+}}$至终点,记下所用体积$V\ mL$,则过量${Ag^{+}}$的物质的量为$cV× 10^{-3}\ mol$,与${Cl^{-}}$反应的${Ag^{+}}$的物质的量为$0.1000\ mol·L^{-1}× 0.05\ L - cV× 10^{-3}\ mol = (5 - cV)× 10^{-3}\ mol$,${Cl}$元素的质量分数为$\frac{(5 - cV)× 10^{-3}\ mol× 35.5\ g·mol^{-1}}{m\ g}× 100\% = \frac{(5 - cV)× 35.5× 10^{-3}}{m}× 100\%$。步骤①若不加入稀硝酸,则其中过量的氢氧化钠可以和硝酸银反应生成沉淀,则被消耗的硝酸银偏多,则所测${Cl}$元素含量将会偏大。
答案
(1)打开$K_{1}$、$K_{2}$,关闭$K_{3}$、$K_{4}$ 加快反应速率,防止${PCl_{3}}$汽化 在球形冷凝管上端连接一个装有碱石灰的干燥管
(2)${POCl_{3} + 6OH^{-}\xlongequal{}PO^{3 - }_{4} + 3Cl^{-} + 3H_{2}O}$
(3)滴入最后半滴标准液,溶液变为浅红色,且半分钟内不褪色 $\frac{(5 - cV)× 35.5× 10^{-3}}{m}× 100\%$或$\frac{3.55(5 - cV)}{m}\%$ 偏大
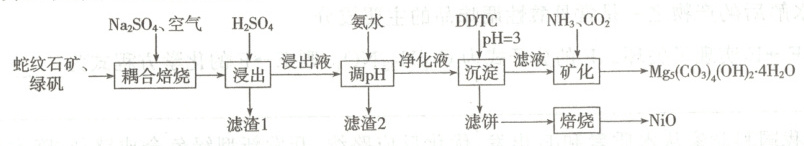
17. (14分)蛇纹石矿(主要成分为$MgO$、$SiO_{2}$和少量铁、铝、镍等元素)与绿矾耦合焙烧提取富镁溶液矿化$CO_{2}$并回收镍。工艺流程如图。
已知:①DDTC[$(C_{2}H_{5})_{NCSNa}$]是一种常见的络合剂,对低浓度镍离子的络合效果好;
②$25^{\circ}C$时,$K_{sp}[Fe(OH)_{3}]=4.0×10^{-38}$,$K_{sp}[Al(OH)_{3}]=1.3×10^{-33}$。
回答下列问题:
(1)“耦合焙烧”过程中绿矾做助剂,将蛇纹石矿的金属元素全部转化为硫酸盐。“滤渣1”的主要成分为
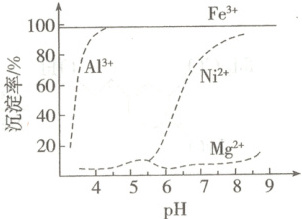
(2)$25^{\circ}C$时,pH对“浸出液”中金属沉淀率的影响如图,加入氨水调节的适宜pH≈
(3)“滤饼”主要成分的结构中存在两个通过配位键形成的稳定四元环。配位原子为
(4)“矿化”的离子方程式为
(5)已知蛇纹石矿中氧化镁含量约为30%,提取过程中镁损失率为20%。$80^{\circ}C$时,若矿化率为95%,则每1 000 kg蛇纹石矿可固定$CO_{2}$的质量约为

已知:①DDTC[$(C_{2}H_{5})_{NCSNa}$]是一种常见的络合剂,对低浓度镍离子的络合效果好;
②$25^{\circ}C$时,$K_{sp}[Fe(OH)_{3}]=4.0×10^{-38}$,$K_{sp}[Al(OH)_{3}]=1.3×10^{-33}$。

回答下列问题:
(1)“耦合焙烧”过程中绿矾做助剂,将蛇纹石矿的金属元素全部转化为硫酸盐。“滤渣1”的主要成分为
SiO2
(填化学式)。(2)$25^{\circ}C$时,pH对“浸出液”中金属沉淀率的影响如图,加入氨水调节的适宜pH≈
4.5
。当铝离子恰好完全沉淀时,$c(Fe^{3+})=$$3.1×10^{-10}$
$mol·L^{-1}$(保留两位有效数字)。(已知当离子浓度$c\leqslant1.010^{-5}\ mol·L^{-1}$时认为已完全沉淀)(3)“滤饼”主要成分的结构中存在两个通过配位键形成的稳定四元环。配位原子为
S
,原因S 原子电负性小,半径大,更易给出电子
。(4)“矿化”的离子方程式为
$5Mg^{2+} + 10NH3 + 4CO2 + 10H2O → Mg5(CO3)4(OH)2·4H2O↓ + 10NH4^{+}$
。(5)已知蛇纹石矿中氧化镁含量约为30%,提取过程中镁损失率为20%。$80^{\circ}C$时,若矿化率为95%,则每1 000 kg蛇纹石矿可固定$CO_{2}$的质量约为
200.64
kg。
答案:
17. 解析
(1)滤渣 1 的主要成分为${SiO_{2}}$。
(2)根据图示,为使${Fe^{3 + }}$、${Al^{3 + }}$尽可能沉淀,${Ni^{2 + }}$、${Mg^{2 + }}$尽可能不损失,加入氨水调节的适宜${pH}\approx 4.5$。当铝离子恰好完全沉淀时,$c({Al^{3 + }}) = 1.0× 10^{-5}\ mol·L^{-1}$,根据$\frac{c({Fe^{3 + }})}{c({Al^{3 + }})} = \frac{K_{sp}[{Fe(OH)_{3}}]}{K_{sp}[{Al(OH)_{3}}]}$得此时$c({Fe^{3 + }})\approx 3.1× 10^{-10}\ mol·L^{-1}$。
(3)DDTC 中能够提供孤电子对的原子有 N、S,S 的电负性小于 N 的,S 的原子半径大于 N 的,因此 S 更容易提供孤电子对与镍离子形成配位键,则配位原子为 S。
(4)根据流程图中提供的信息,“矿化”时反应的离子方程式为${5Mg^{2 + } + 10NH_{3} + 4CO_{2} + 10H_{2}O\xlongequal{}Mg_{5}(CO_{3})_{4}(OH)_{2}· 4H_{2}O\downarrow + 10NH^{+}_{4}}$。
(5)根据有关数据,“矿化”时实际反应的${Mg^{2 + }}$质量为$1000\ kg× 30\%×\frac{24}{40}× 100\%×(1 - 20\%)× 95\% = 136.8\ kg$,根据“矿化”反应的离子方程式得
$\begin{array}{ccc}5{Mg^{2 + }} & \sim & 4{CO_{2}} \\5× 24 & & 4× 44 \\136.8\ kg & & m \\\end{array}$
$m = \frac{4× 44× 136.8}{5× 24}\ kg = 200.64\ kg$,
因此每$1000\ kg$蛇纹石矿可固定${CO_{2}}$的质量约为$200.64\ kg$。
答案
(1)${SiO_{2}}$
(2)$4.5$ $3.1× 10^{-10}$
(3)S S 原子电负性小,半径大,更易给出电子
(4)${5Mg^{2 + } + 10NH_{3} + 4CO_{2} + 10H_{2}O\xlongequal{}Mg_{5}(CO_{3})_{4}(OH)_{2}· 4H_{2}O\downarrow + 10NH^{+}_{4}}$
(5)$200.64$
(1)滤渣 1 的主要成分为${SiO_{2}}$。
(2)根据图示,为使${Fe^{3 + }}$、${Al^{3 + }}$尽可能沉淀,${Ni^{2 + }}$、${Mg^{2 + }}$尽可能不损失,加入氨水调节的适宜${pH}\approx 4.5$。当铝离子恰好完全沉淀时,$c({Al^{3 + }}) = 1.0× 10^{-5}\ mol·L^{-1}$,根据$\frac{c({Fe^{3 + }})}{c({Al^{3 + }})} = \frac{K_{sp}[{Fe(OH)_{3}}]}{K_{sp}[{Al(OH)_{3}}]}$得此时$c({Fe^{3 + }})\approx 3.1× 10^{-10}\ mol·L^{-1}$。
(3)DDTC 中能够提供孤电子对的原子有 N、S,S 的电负性小于 N 的,S 的原子半径大于 N 的,因此 S 更容易提供孤电子对与镍离子形成配位键,则配位原子为 S。
(4)根据流程图中提供的信息,“矿化”时反应的离子方程式为${5Mg^{2 + } + 10NH_{3} + 4CO_{2} + 10H_{2}O\xlongequal{}Mg_{5}(CO_{3})_{4}(OH)_{2}· 4H_{2}O\downarrow + 10NH^{+}_{4}}$。
(5)根据有关数据,“矿化”时实际反应的${Mg^{2 + }}$质量为$1000\ kg× 30\%×\frac{24}{40}× 100\%×(1 - 20\%)× 95\% = 136.8\ kg$,根据“矿化”反应的离子方程式得
$\begin{array}{ccc}5{Mg^{2 + }} & \sim & 4{CO_{2}} \\5× 24 & & 4× 44 \\136.8\ kg & & m \\\end{array}$
$m = \frac{4× 44× 136.8}{5× 24}\ kg = 200.64\ kg$,
因此每$1000\ kg$蛇纹石矿可固定${CO_{2}}$的质量约为$200.64\ kg$。
答案
(1)${SiO_{2}}$
(2)$4.5$ $3.1× 10^{-10}$
(3)S S 原子电负性小,半径大,更易给出电子
(4)${5Mg^{2 + } + 10NH_{3} + 4CO_{2} + 10H_{2}O\xlongequal{}Mg_{5}(CO_{3})_{4}(OH)_{2}· 4H_{2}O\downarrow + 10NH^{+}_{4}}$
(5)$200.64$
查看更多完整答案,请扫码查看


