2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
17. (14 分)以 NOₓ为主要成分的雾霾综合治理是当前重要的研究课题,其中汽车尾气的处理尤为重要。
已知:N₂(g) + O₂(g) ⇌ 2NO(g) ΔH₁ = a kJ·mol⁻¹
C(s) + O₂(g) ⇌ CO₂(g) ΔH₂ = b kJ·mol⁻¹
2C(s) + O₂(g) ⇌ 2CO(g) ΔH₃ = c kJ·mol⁻¹
请回答下列问题:
(1)汽车尾气中的 NO 和 CO 在催化转换器中发生以下反应可减少尾气污染:2CO(g) + 2NO(g) ⇌ N₂(g) + 2CO₂(g) ΔH。则 ΔH =
(2)某温度时,向 2 L 恒容密闭体系中通入 2 mol CO 和 1 mol NO 发生反应:2CO(g) + 2NO(g) ⇌ N₂(g) + 2CO₂(g)
①下列能说明反应达到平衡状态的是
a. 2v正(NO) = v逆(N₂)
b. 体系中混合气体密度不再改变
c. CO 与 NO 转化率的比值不再改变
d. 该温度下,$\frac{c(N_{2})·c^{2}(CO_{2})}{c^{2}(CO)·c^{2}(NO)}$的值不再改变
②某温度下,该反应达平衡时 CO 与 CO₂体积分数之比为 3 : 2,则平衡常数为
③平衡时 CO₂的体积分数与温度、压强的关系如图所示。则温度:T₁
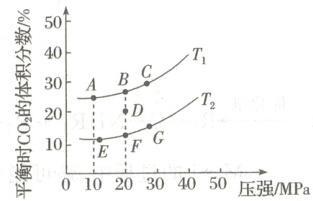
④若在 D 点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中 A~G 点中的
已知:N₂(g) + O₂(g) ⇌ 2NO(g) ΔH₁ = a kJ·mol⁻¹
C(s) + O₂(g) ⇌ CO₂(g) ΔH₂ = b kJ·mol⁻¹
2C(s) + O₂(g) ⇌ 2CO(g) ΔH₃ = c kJ·mol⁻¹
请回答下列问题:
(1)汽车尾气中的 NO 和 CO 在催化转换器中发生以下反应可减少尾气污染:2CO(g) + 2NO(g) ⇌ N₂(g) + 2CO₂(g) ΔH。则 ΔH =
2b - a - c
kJ·mol⁻¹(用含 a、b、c 的表达式表示)。已知该反应低温时为自发反应,则该反应的反应热 ΔH<
(填“>”“<”或“=”)0。(2)某温度时,向 2 L 恒容密闭体系中通入 2 mol CO 和 1 mol NO 发生反应:2CO(g) + 2NO(g) ⇌ N₂(g) + 2CO₂(g)
①下列能说明反应达到平衡状态的是
d
(填字母)。a. 2v正(NO) = v逆(N₂)
b. 体系中混合气体密度不再改变
c. CO 与 NO 转化率的比值不再改变
d. 该温度下,$\frac{c(N_{2})·c^{2}(CO_{2})}{c^{2}(CO)·c^{2}(NO)}$的值不再改变
②某温度下,该反应达平衡时 CO 与 CO₂体积分数之比为 3 : 2,则平衡常数为
80/9
。该反应中的 v正 = k正·c²(NO)c²(CO),v逆 = k逆·c(N₂)c²(CO₂),则该反应达到平衡时,k正>
(填“>”“<”或“=”)k逆。③平衡时 CO₂的体积分数与温度、压强的关系如图所示。则温度:T₁
<
(填“>”或“<”)T₂,理由是该反应的正反应是放热反应,当压强相同时,升高温度,平衡逆向移动,CO₂的体积分数降低,所以T₁ < T₂
。
④若在 D 点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中 A~G 点中的
E
(填字母)点。
答案:
17.解析
(1)①${N_{2}(g) + O_{2}(g)⇌ 2NO(g)}\ \ \Delta H_{1} = a\ kJ· mol^{-1}$
②${C(s) + O_{2}(g)⇌ CO_{2}(g)}\ \ \Delta H_{2} = b\ kJ· mol^{-1}$
③${2C(s) + O_{2}(g)⇌ 2CO(g)}\ \ \Delta H_{3} = c\ kJ· mol^{-1}$
依据盖斯定律,将反应②$× 2 - $①$ - $③得:${2CO(g) + 2NO(g)⇌ N_{2}(g) + 2CO_{2}(g)}\ \ \Delta H = (2b - a - c)\ kJ· mol^{-1}$。该反应中,反应物气体分子数大于生成物气体分子数,则$\Delta S < 0$,该反应低温时为自发反应,则该反应的反应热$\Delta H < 0$。
(2)①a.$2v_{正}{(NO)} = v_{逆}{(N_{2})}$,反应进行的方向相反,但速率之比不等于化学计量数之比,所以反应未达到平衡状态,a不符合题意;b.体系中混合气体的质量、体积始终不变,密度始终不变,则当密度不再改变时,反应不一定达到平衡状态,b不符合题意;c.设二者的变化量为$x$,则某时刻${CO}$与${NO}$转化率的比值为$\dfrac{\dfrac{x}{2}}{\dfrac{x}{1}} = \dfrac{1}{2}$,此比值为定值,则不管反应是否达到平衡,比值始终不变,所以反应不一定达到平衡状态,c不符合题意;d.该温度下,$\dfrac{c{(N_{2})}· c^{2}{(CO_{2})}}{c^{2}{(CO)}· c^{2}{(NO)}}$的值不再改变,表明浓度商等于化学平衡常数,则反应达到平衡状态,d符合题意。
②某温度时,向$2\ L$恒容密闭体系中通入$2\ mol\ {CO}$和$1\ mol\ {NO}$发生反应:${2CO(g) + 2NO(g)⇌ N_{2}(g) + 2CO_{2}(g)}$,设参加反应的${CO}$物质的量为$y$,则可建立如下三段式:
${2NO(g) + 2CO(g)⇌ N_{2}(g) + 2CO_{2}(g)}$
起始量/mol $1$ $2$ $0$ $0$
变化量/mol $y$ $y$ $0.5y$ $y$
平衡量/mol $1 - y$ $2 - y$ $0.5y$ $y$
某温度下,该反应达平衡时,${CO}$与${CO_{2}}$体积分数之比为$3:2$,即$\dfrac{2 - y}{y} = \dfrac{3}{2}$,$y = 0.8\ mol$,此时${NO}$、${CO}$、${N_{2}}$、${CO_{2}}$的物质的量分别为$0.2\ mol$、$1.2\ mol$、$0.4\ mol$、$0.8\ mol$,则平衡常数为$\dfrac{0.2× 0.4^{2}}{0.6^{2}× 0.1^{2}} = \dfrac{80}{9}$。
该反应中的$v_{正} = k_{正}· c^{2}{(NO)}c^{2}{(CO)}$,$v_{逆} = k_{逆}· c{(N_{2})}c^{2}{(CO_{2})}$,则该反应达到平衡时,$v_{正} = v_{逆}$,即$k_{正}· c^{2}{(NO)}c^{2}{(CO)} = k_{逆}· c{(N_{2})}c^{2}{(CO_{2})}$,$\dfrac{k_{正}}{k_{逆}} = \dfrac{c{(N_{2})}· c^{2}{(CO_{2})}}{c^{2}{(NO)}· c^{2}{(CO)}} = \dfrac{80}{9} > 1$,$k_{正} > k_{逆}$。
③${2CO(g) + 2NO(g)⇌ N_{2}(g) + 2CO_{2}(g)}\ \ \Delta H < 0$,该反应的正反应是放热反应,当压强相同时,升高温度,平衡逆向移动,${CO_{2}}$的体积分数降低,所以$T_{1} < T_{2}$。
④若在$D$点对反应容器升温的同时扩大体积使体系压强减小,平衡都发生逆向移动,${CO_{2}}$的体积分数减小,则重新达到的平衡状态可能是图中$A~G$点中的$E$点。
答案
(1)$2b - a - c$ $<$
(2)①d ②$\dfrac{80}{9}$ $>$ ③$<$ 该反应的正反应是放热反应,当压强相同时,升高温度,平衡逆向移动,${CO_{2}}$的体积分数降低,所以$T_{1} < T_{2}$ ④$E$
(1)①${N_{2}(g) + O_{2}(g)⇌ 2NO(g)}\ \ \Delta H_{1} = a\ kJ· mol^{-1}$
②${C(s) + O_{2}(g)⇌ CO_{2}(g)}\ \ \Delta H_{2} = b\ kJ· mol^{-1}$
③${2C(s) + O_{2}(g)⇌ 2CO(g)}\ \ \Delta H_{3} = c\ kJ· mol^{-1}$
依据盖斯定律,将反应②$× 2 - $①$ - $③得:${2CO(g) + 2NO(g)⇌ N_{2}(g) + 2CO_{2}(g)}\ \ \Delta H = (2b - a - c)\ kJ· mol^{-1}$。该反应中,反应物气体分子数大于生成物气体分子数,则$\Delta S < 0$,该反应低温时为自发反应,则该反应的反应热$\Delta H < 0$。
(2)①a.$2v_{正}{(NO)} = v_{逆}{(N_{2})}$,反应进行的方向相反,但速率之比不等于化学计量数之比,所以反应未达到平衡状态,a不符合题意;b.体系中混合气体的质量、体积始终不变,密度始终不变,则当密度不再改变时,反应不一定达到平衡状态,b不符合题意;c.设二者的变化量为$x$,则某时刻${CO}$与${NO}$转化率的比值为$\dfrac{\dfrac{x}{2}}{\dfrac{x}{1}} = \dfrac{1}{2}$,此比值为定值,则不管反应是否达到平衡,比值始终不变,所以反应不一定达到平衡状态,c不符合题意;d.该温度下,$\dfrac{c{(N_{2})}· c^{2}{(CO_{2})}}{c^{2}{(CO)}· c^{2}{(NO)}}$的值不再改变,表明浓度商等于化学平衡常数,则反应达到平衡状态,d符合题意。
②某温度时,向$2\ L$恒容密闭体系中通入$2\ mol\ {CO}$和$1\ mol\ {NO}$发生反应:${2CO(g) + 2NO(g)⇌ N_{2}(g) + 2CO_{2}(g)}$,设参加反应的${CO}$物质的量为$y$,则可建立如下三段式:
${2NO(g) + 2CO(g)⇌ N_{2}(g) + 2CO_{2}(g)}$
起始量/mol $1$ $2$ $0$ $0$
变化量/mol $y$ $y$ $0.5y$ $y$
平衡量/mol $1 - y$ $2 - y$ $0.5y$ $y$
某温度下,该反应达平衡时,${CO}$与${CO_{2}}$体积分数之比为$3:2$,即$\dfrac{2 - y}{y} = \dfrac{3}{2}$,$y = 0.8\ mol$,此时${NO}$、${CO}$、${N_{2}}$、${CO_{2}}$的物质的量分别为$0.2\ mol$、$1.2\ mol$、$0.4\ mol$、$0.8\ mol$,则平衡常数为$\dfrac{0.2× 0.4^{2}}{0.6^{2}× 0.1^{2}} = \dfrac{80}{9}$。
该反应中的$v_{正} = k_{正}· c^{2}{(NO)}c^{2}{(CO)}$,$v_{逆} = k_{逆}· c{(N_{2})}c^{2}{(CO_{2})}$,则该反应达到平衡时,$v_{正} = v_{逆}$,即$k_{正}· c^{2}{(NO)}c^{2}{(CO)} = k_{逆}· c{(N_{2})}c^{2}{(CO_{2})}$,$\dfrac{k_{正}}{k_{逆}} = \dfrac{c{(N_{2})}· c^{2}{(CO_{2})}}{c^{2}{(NO)}· c^{2}{(CO)}} = \dfrac{80}{9} > 1$,$k_{正} > k_{逆}$。
③${2CO(g) + 2NO(g)⇌ N_{2}(g) + 2CO_{2}(g)}\ \ \Delta H < 0$,该反应的正反应是放热反应,当压强相同时,升高温度,平衡逆向移动,${CO_{2}}$的体积分数降低,所以$T_{1} < T_{2}$。
④若在$D$点对反应容器升温的同时扩大体积使体系压强减小,平衡都发生逆向移动,${CO_{2}}$的体积分数减小,则重新达到的平衡状态可能是图中$A~G$点中的$E$点。
答案
(1)$2b - a - c$ $<$
(2)①d ②$\dfrac{80}{9}$ $>$ ③$<$ 该反应的正反应是放热反应,当压强相同时,升高温度,平衡逆向移动,${CO_{2}}$的体积分数降低,所以$T_{1} < T_{2}$ ④$E$
查看更多完整答案,请扫码查看


